微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定温度下,向a L密闭容器中加入1mol X气体和 2mol Y气体,发生如下反应:X(g)+2Y(g)  2Z(g),此反应达到平衡的标志是? ( )
2Z(g),此反应达到平衡的标志是? ( )
A.容器内压强不随时间变化
B.v正(X)=v逆(Z)
C.容器内X、Y、Z的浓度之比为1:2:2
D.单位时间消耗0.1mol X同时生成0.2mol Z
2、选择题 在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)(单位:mol L-1
L-1 s-1)表示,且v(A)、v(B)、v(C)之间有以下关系:v(B)=3v(A),v(C)=2v(A),3v(C)?=2v(B),则此反应可表示为
s-1)表示,且v(A)、v(B)、v(C)之间有以下关系:v(B)=3v(A),v(C)=2v(A),3v(C)?=2v(B),则此反应可表示为
[? ]
A.?A(g)?+B(g) C(g)
C(g)
B.?2A(g)?+?2B(g) 3C(g)
3C(g)
C.?3A(g)?+B(g) 2C(g)
2C(g)
D.?A(g)?+3B(g) 2C(g)
2C(g)
3、选择题 反应2A(g)+B(g) 2C(g)? ΔH>0。下列反应条件有利于生成C的是(? )
2C(g)? ΔH>0。下列反应条件有利于生成C的是(? )
A.低温、低压
B.低温、高压
C.高温、高压
D.高温、低压
4、选择题 反应4A(s)+3B(g)? = 2C(g)+D(s),经2min,B的浓度减少0.6 mol/L。对此反应速率的表示不正确的是?
[? ]
A.在2 min内的反应速率用B表示为0.3 mol/(L·min)
B.在2 min内用C表示反应速率是0.2 mol/(L·min)
C.v (B)=3v (D)
D.v (A)=0.4 mol/(L·min)
5、填空题 (13分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:? CO(g) + 2H2(g)? ?CH3OH(g)? ΔH1
?CH3OH(g)? ΔH1
反应II: CO2(g) + 3H2(g)  ?CH3OH(g)? +? H2O(g)? ΔH2
?CH3OH(g)? +? H2O(g)? ΔH2
①上述反应符合“原子经济”原则的是?(填“I”或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度
| 250℃
| 300℃
| 350℃
|
K
| 2.041
| 0.270
| 0.012
|
?
由表中数据判断ΔH1?0 (填“>”、“=”或“<”)。?
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CH3OH)= 0.8 mol/L,则CO的转化率为?,此时的温度为?(从上表中选择)。
④恒温、恒容时,下列情况不能说明反应I已经达到化学平衡状态的是________________。
 a、容器各物质的浓度保持不变;? b、容器内压强保持不变;
a、容器各物质的浓度保持不变;? b、容器内压强保持不变;
 c、υ(CO)消耗==1/2υ(H2)生成 ? d 、容器内的密度保持不变
c、υ(CO)消耗==1/2υ(H2)生成 ? d 、容器内的密度保持不变
(2)25℃、101kPa时,燃烧16g液体甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式:?。
(3)某实验小组依据甲醇燃烧的反应原理,设计一个燃料电池电解Na2SO4溶液(图如下)。请根据图示回答下列问题:
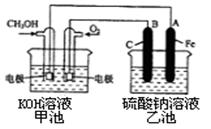
①通入甲醇蒸气的电极应为???极(填写“正”或“负”),?该电极上发生的电极反应是?(填字母代号)。
a.2CH3OH —12 e- +3O2 ===?2CO2 + 4 H2O?
b.CH3OH—6 e- + 8 OH- ?="==" CO32- + 6H2O
c.O2 + 2H2O + 4 e- ="==" 4OH-?
d.O2— 4 e- + 4H+?="==" 2H2O
②写出电极A的名称?。写出B电极的电极反应式?。
③当酸性甲醇燃料电池消耗3.36 L 氧气时(折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是?。