微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-,横坐标表示加入NaOH的体积)。根据图示判断,下列说法正确的是(?)
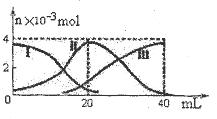
A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:
C(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.HA-的电离程度小于水解程度
C.滴加过程中当溶液呈中性时,V(NaOH)<20mL
D.当V(NaOH)=40mL时,向所得溶液加水稀释的过程中pH增大
参考答案:A
本题解析:当V(NaOH)=20mL时,H2A与NaOH刚好反应生成4x10-3 mol NaHA,根据图知HA-
的物质的量略小于4x10-3 mol,知c (Na+)>c(HA-),而A2-的物质的量略小于10-3 mol,
H2A不为0,表明HA-少量电离(c(HA-)>c(H+)),少量发生水解,又A2-的量大于H2A的量,
则HA-的电离程度大于水解程度,HA-可电离出H+、A2-,而水电离出 H+及 OH-,所以
c(H+)>c(A2-),c(H+)>c(OH-),溶液显酸性,c(A2-)>c(OH-)(A2-的物质的量略小于10-3 mol),
滴加过程中当溶液呈中性时,V(NaOH)>20mL所以A正确,B错,C错;当V(NaOH)=40mL
时,H2A与NaOH刚好反应生成4x10-3 mol Na2A,由图知A2-略水解,溶液略呈碱性,向所得
溶液加水稀释的过程中虽促进了A2-的水解但c(OH-)减小,pH减小,D错。
本题难度:一般
2、计算题 (6分)某温度下,将一定量密度为1.15 g·cm-3的NaCl溶液用石墨电极通电电解,设NaCl恰好完全反应,且无其他反应发生,得到的溶液中氧元素的质量分数为80%。
(1)求电解后溶液中溶质与溶剂的物质的量之比。
(2)求原NaCl溶液的物质的量浓度。
参考答案:(1)1∶10?(2)4.48 mol·L-1
本题解析:(1)设食盐水中含NaCl x mol,电解后溶液中含有y mol H2O。
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
2 mol ?2 mol? 2 mol
x mol?x mol? x mol
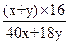 ×100%="80%?" 解得:x∶y=1∶10。
×100%="80%?" 解得:x∶y=1∶10。
(2)原NaCl溶液的物质的量浓度:
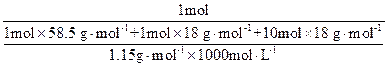
="4.48" mol·L-1。
本题难度:简单
3、选择题 用水稀释0.1mol/L醋酸溶液时,溶液中随着水量的增加而减小的是( )
A.c(H+)/c(CH3COOH)
B.c(CH3COOH)/c(H+)
C.c(H+)和c(OH-)的乘积
D.H+的物质的量
参考答案:A.加水稀释醋酸,促进醋酸电离,则氢离子个数增大,醋酸分子个数减少,所以c(H+)/c(CH3COOH)增大,故A错误;
B.加水稀释醋酸,促进醋酸电离,则氢离子个数增大,醋酸分子个数减少,所以c(CH3COOH)/c(H+),故B正确;
C.温度不变,水的离子积常数不变,所以c(H+)和c(OH-)的乘积不变,故C错误;
D.加水稀释,促进醋酸电离,所以氢离子的物质的量增大,故D错误;
故选B.
本题解析:
本题难度:一般
4、选择题 现有常温下的四种溶液(如下表),下列有关叙述正确的是( )
| ① | ② | ③ | ④
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
PH
11
11
3
3
|
A.分别加水稀释10倍,四种溶液的PH:①>②>④>③
B.将③、④分别稀释到PH=5,由水电离出氢离子的浓度均减小100倍
C.在①、②中分别加入适量的氯化铵晶体后,①的PH减小,②的PH不变
D.将①、④两种溶液等体积混合,所得溶液中:c(OH-):c(H+)<1
参考答案:A.氨水加水稀释时,电离程度增大,进一步电离出OH-离子,醋酸加水稀释电离程度增大,进一步电离出氢离子,则分别加水稀释10倍后四种溶液的pH大小顺序为①>②>④>③,故A正确;
B.醋酸为弱电解质,将①、④两种溶液分别稀释有PH=3到PH=5,依据[H+][OH-]=10-14,所以由水电离出氢离子的浓度均增大100倍,故B错误;
C.在氨水中加入氯化铵,抑制氨水的电离,溶液pH减小,在氢氧化钠溶液中中加入氯化铵,生成一水合氨,溶液pH减小,故C错误;
D.PH=11的氨水和PH=3的盐酸溶液,溶液中氢氧根离子和氢离子浓度相同,等体积混合,由于氨水是弱电解质存在电离平衡,混合后氢离子全部反应反应,氨水又电离出氢氧根离子,所以所得溶液中:c(OH-):c(H+)>1,故D错误;
故选A.
本题解析:
本题难度:一般
5、选择题 常温时,下列有关于电解质溶液的叙述正确的是( )
A.稀释pH=10的氨水,溶液中所有离子的浓度均降低
B.pH均为5的盐酸和氯化铵溶液中,水的电离程度相同
C.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗NaOH的物质的量多
参考答案:A、一定温度下,水的电离常数不变,KW=c(H+)?C(OH-),氨水是弱电解质,稀释后溶液的pH减小,C(OH-)减小,KW不变,所以C(OH-)增大,故A错误;
B、盐酸属于强电解质,pH为5的盐酸中,酸中的氢离子抑制了水的电离,使得水的电离程度降低;氯化铵是强酸弱碱盐,溶液中,铵离子水解,会大大促进了水的电离,所以他们的电离程度不同,故B错误;
C、硫酸氢钠是强电解质,加入水中后,溶液中c(H+)会大大增加;KW与溶液的浓度无关,只受温度影响,故C正确;
D、由于醋酸是弱电解质,在溶液中部分发生电离;硫酸是强电解质,完全电离,pH相同的硫酸和醋酸,c(醋酸)会远远大于c(硫酸),同体积的两溶液中,n(醋酸)>n(硫酸),所以醋酸消耗的NaOH的物质的量多,故D错误.
故选C.
本题解析:
本题难度:简单