微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 I.利用含锰废水(主要含Mn2+、SO 、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:

已知某些物质完全沉淀的pH如下表:

回答下列问题:
(1)过程②中,所得滤渣的主要成分是?。
(2)过程③中,发生反应的离子方程式是?。
(3)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3的反应的离子方程式是?。
(4)由MnCO3可制得重要的催化剂MnO2:2MnCO3+O2=2MnO2+2CO2。
现在空气中加热460.0 g MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是?(用百分数表示,小数点后保留1位)。
Ⅱ.常温下,浓度均为0.1 mol/L的下列六种溶液的pH如下表:
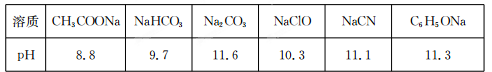
(1)上述盐溶液中的阴离子,结合H+能力最强的是?。
(2)根据表中数据判断,浓度均为0.0l mol/L的下列物质的溶液中,酸性最强的是
(填序号)。
A.HCN?B.HC1O? C.C6H5OH? D.CH3 COOH? E.H2 CO3
(3)据上表数据,请你判断下列反应不能成立的是?(填序号)。
A.HCN+ Na2 CO3=NaHCO3+NaCN
B.CH3 COOH+NaCN=CH3 COONa+HCN
C.CO2 +H2O+2C6 H5ONa=Na2 CO3 +2C6 H5OH
D.CH3 COONa+HClO=NaClO十CH3 COOH
参考答案:I.(1)Fe(OH)3,Al(OH)3
(2)MnS + Cu2+ = Mn2+ + CuS
(3)Mn2++2HCO3- =MnCO3 +CO2↑+H2O
(4)78.6%
II.(1)CO32-;(2)D;(3)CD。
本题解析:I.(1)调节pH在5.2,由题意知Fe2+和Al3+均以Fe(OH)3和Al(OH)3沉淀状态存在;(2)加入MnS是为了使其中Cu2+产生CuS沉淀除去,故搅拌目的是使MnS 与 Cu2+快速、充分反应,离子方程式MnS + Cu2+ = Mn2+ + CuS↓;(3)由题意知Mn2+和加入的HCO3-反应,产生CO2气体和MnCO3沉淀,故离子方程式Mn2++2HCO3- =MnCO3 +CO2↑+H2O;(4)MnCO3受热分解为MnO,MnO部分氧化为MnO2,产品中杂质有MnO,460.0 gMnCO3,物质的量为4mol,受热产生4molMnO,设产生MnO2物质的量为xmol,即有xmolMnO氧化,剩余MnO为(4-x)mol,产物的总质量为(4-x)mol×71g·mol-1+xmol×87g·mol-1=332g,x=3,则MnO2的质量分数=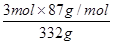 ?=78.6%。
?=78.6%。
II.(1)对应酸的酸性越弱,其阴离子越易水解,其阴离子结合质子能力越强,根据表格中数据可知CO32-结合质子能力最强;(2)对应酸的酸性越弱,其阴离子越易水解,其盐溶液碱性越强,所以PH最小的酸性最强,所以CH3COOH酸性最强,故答案为D;(3)复分解反应中,碱性强的物质置换碱性弱的物质,酸性强的物质置换酸性弱的物质,根据以上知识对各选项进行判断即可;故答案为CD。
本题难度:困难
2、填空题 (12分)在稀氨水中存在下述电离平衡NH3 + H2O NH3 ·H2O
NH3 ·H2O NH4+ + OH—,分别加入少量下列物质,溶液中c ( OH—) 如何变化?(填
NH4+ + OH—,分别加入少量下列物质,溶液中c ( OH—) 如何变化?(填 “增大”“减小”或“不变”);平衡移动方向如何(填“正向”或“逆向”)?
“增大”“减小”或“不变”);平衡移动方向如何(填“正向”或“逆向”)?
加入 的物质 的物质
| 少量(NH4)2SO4固体
| 少量HNO3溶液
| 少量KOH溶液
|
c( OH—)的变化
| ?
| ?
| ?
|
平衡移动方向
| ?
| ?
| ?
参考答案: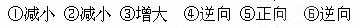
本题解析:略
本题难度:一般
3、选择题 下列事实能够说明亚硝酸(HNO2)为弱电解质的是( )
A.0.1mol/L的亚硝酸水溶液的PH=2.1
B.亚硝酸不与硫酸钠溶液反应
C.25℃时,HNO2的水溶液的PH<7
D.用亚硝酸做导电实验时,灯泡很暗
参考答案:A.0.1mol/L的亚硝酸水溶液的PH=2.1,说明亚硝酸不能完全电离,为弱电解质,故A正确;
B.不符合复分解反应的条件,即使是强酸也不能与硫酸钠反应,则不能证明亚硝酸为弱电解质,故B错误;
C.25℃时,HNO2的水溶液的PH<7,只能证明呈酸性,但无法确定电离程度,不能证明为弱电解质,故C错误;
D.用亚硝酸做导电实验时,灯泡很暗,由于浓度未知,则不能证明为弱电解质,故D错误.
故选A.
本题解析:
本题难度:简单
4、选择题 关于pH相同的醋酸和盐酸,下列叙述不正确的是
A.取等体积的两种酸分别稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m>n
B.取等体积的两种酸分别与完全一样的足量锌粒反应,开始时反应速率:盐酸大于醋酸
C.取等体积的两种酸分别中和NaOH溶液,醋酸消耗NaOH的物质的量比盐酸消耗的多
D.两种酸中c(CH3COO-)=c(Cl-)
|
参考答案:B
本题解析:A、pH相同、体积相同的醋酸和盐酸两种溶液分别加水稀释后,促进醋酸的电离,结果两溶液的pH仍然相同,所以醋酸稀释的倍数大,即m>n,故A正确;B、pH相同则氢离子浓度相同,所以取等体积的两种酸溶液分别与完全一样的足量锌粒反应,开始时反应速率盐酸等于醋酸,故B错误;C、pH相同、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸,所以醋酸消耗NaOH的物质的量比盐酸多,故C正确;D、pH相同则氢离子浓度相同,所以氢氧根离子浓度也相同,根据电荷守恒c(CH3COO-)=c(Cl-),故D正确。
考点:本题考查弱电解质的电离平衡、离子浓度判断。
本题难度:一般
5、选择题 室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是(? )
A.溶液中导电粒子的数目减少
B.溶液中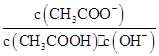 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
参考答案:B
本题解析:A项,加水稀释有利于醋酸的电离,故溶液中导电粒子的数目增加,A错误;B项,在稀释的过程中,温度不变,故Ka=c(CH3COO-)c(H+)/c(CH3COOH)不变,又因为c(H+)=Kw/c(OH-),故c(CH3COO-)×Kw/[c(CH3COOH)·c(OH-)]=Ka,Kw在室温下也是常数,故B正确;C项,电离程度虽然增大,但c(H+)减小,C错误;D项,加入10 mL pH=11的NaOH溶液,混合液中和后,因醋酸还有大量剩余,故pH应小于7,D错误。
本题难度:一般