微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,0.1 mol/L某一元酸(HA)溶液中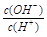 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中水电离出的c(H+)=10-10 mol/L
D.与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为
c(A-)>c(Na+)>c(OH-)>c(H+)
参考答案:A
本题解析:常温下,水的离子积为1×10-14,结合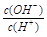 =1×10-8可得出,溶液中的
=1×10-8可得出,溶液中的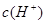 =1×10-3mol/L,可见一元酸没有完全电离,为弱酸:HA
=1×10-3mol/L,可见一元酸没有完全电离,为弱酸:HA H++OH—;
H++OH—;
A.溶液中加入一定量CH3COONa晶体,CH3COO—会结合溶液中的H+,使溶液中的c(H+)减少,c(OH-)必定增加;加水稀释,溶液酸性减弱,c(H+)减小,c(OH-)增大,符合题意
B.由上面的分析可知,溶液中的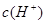 =c(A-)=1×10-3mol/L,错误
=c(A-)=1×10-3mol/L,错误
C.对于一元酸溶液来说,水电离出的c(H+)等于溶液中c(OH-),即10-11mol/L,排除
D.所给离子顺序,很明显违背了电荷守恒原则,排除。
故答案为A
本题难度:一般
2、选择题 常温下将0.1 mol/L甲酸(HCOOH)溶液加水稀释, 下列说法正确的是?
[? ]
A.溶液中c(H+)和c(OH-)都减小
B.溶液中c(H+)/c(HCOOH)减小
C.HCOO-离子的数目增大
D.溶液的pH减小
参考答案:C
本题解析:
本题难度:一般
3、选择题 双氧水(H2O2)和水都是极弱的电解质,但H2O2比H2O更显酸性。
(1)若把H2O2看成是二元弱酸,请写出它在水中的电离方程式:
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出H2O2与Ba(OH)2作用形成正盐的化学方程式: ,
(3)水电离生成H3O+和OH-叫做水的自偶电离。同水一样,H2O2也有极微弱的自偶电离,其自偶电离的方程式:
参考答案:(1)H2O2 H++HO2- HO2-
H++HO2- HO2-  2H++O22-
2H++O22-
(2)H2O2+Ba(OH)2=BaO2+2H2O
(3)H2O2+H2O2 H3O2++HO2-
H3O2++HO2-
本题解析:(1)过氧化氢是弱电解质,H2O2溶液显酸性属于二元弱酸分部电离,电离的方程式为: H2O2?H++HO2- HO2-?H++O22-;(2)H2O2显弱酸性,若与Ba(OH)2反应,即可看做为酸碱中和反应。其反应方程式为:H2O2+Ba(OH)2=BaO2+2H2O(3)由水电离生反应方程式:H2O+H2O H3O+OH-可知,水电离出氢离子,形成水合氢离子。故H2O2电离方程式为:H2O2+H2O2
H3O+OH-可知,水电离出氢离子,形成水合氢离子。故H2O2电离方程式为:H2O2+H2O2 H3O2++HO2-
H3O2++HO2-
考点:电离方程式的书写;离子方程式的书写
本题难度:一般
4、选择题 下列物质的水溶液能导电而本身是非电解质的是
A.氨气
B.氮气
C.氢氧化钠
D.硫酸钡