|
高中化学知识点讲解《热化学方程式》考点预测(2017年强化版)(六)
2017-08-08 03:55:42
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:H—H、Cl—Cl、H—Cl的键能分别为436 kJ/mol、243 kJ/mol和431 kJ/mol,估计1molCl2和1molH2完全反应生成2 molHCl的反应热为 ( )
A.-183 kJ/mol
B.-91.5 kJ/mol
C.+183 kJ/mol
D.+91.5 kJ/mol
|
参考答案:A
本题解析:H2(g)+Cl2(g)=2HCl(g)的反应热=生成物的键能减反应物的键能=436kJ?mol-1+243kJ?mol-1-2×431 kJ?mol-1=
-183kJ?mol-1,故1mol氢气与1mol氯气反应时放出热量为183KJ,故选A。
考点:有关反应热的计算
点评:本题主要考查了反应热的计算,难度不大,根据课本知识即可完成。
本题难度:一般
2、填空题 工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。 CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
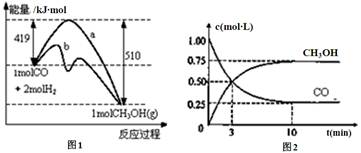
请回答下列问题:
(1)在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g) CH3OH(g)的△H= 。 CH3OH(g)的△H= 。
(2)下列说法正确的是
A.起始充入的CO的物质的量为1mol
B.增加CO的浓度,H2的转化率会增大
C.容器中压强恒定时,反应达到平衡状态
(3)从反应开始到建立平衡,v(CO)= ;达到平衡时,c(H2)= ,该温度下CO(g)+2H2(g)  CH3OH(g)的化学平衡常数为 。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡 移动 (填“正向”、“逆向”或“不”)。 CH3OH(g)的化学平衡常数为 。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡 移动 (填“正向”、“逆向”或“不”)。
(4)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol
又知H2O(l)= H2O(g);ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
参考答案:(1)b -91kJ/mol (2)ABC(3)0.075mol/(L·min) 0.5mo/L 12 正向(4)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-281kJ/mol(3分)
本题解析:(1)根据图像可知,b曲线能量较低,故b为加入催化剂。根据图像可知△H=419kJ/mol-510kJ/mol=-91kJ/mol。(2)根据图像2可知,起始是加入CO的浓度为1mol/L,10min后达到平衡,平衡时CO的转化率为(1mol/L-0.25mol/L)/1mol/L×100%=75%。生产CH3OH的浓度为0.75mol/L。A选项正确,B选项,根据勒夏特列原理可知,增加CO的浓度,H2的转化率将增大。C选项,由于反应物化学计量数之和不等于产物计量数之和可知,当容器中压强恒定时,反应达到平衡状态。故选择A、B、C。(3)v(CO)=(1mol/L-0.25mol/L)/10min=0.075mol/(L·min)。根据CO(g)+2H2(g) CH3OH(g)可知,消耗n(CO):n(H2)=1:2,故消耗H2的物质的量为0.75mol×2=1.5mol,达到平衡时剩余H2的物质的量为2mol-1.5mol=0.5mol。故浓度为 0.5mo/L。该温度下化学平衡常数为0.75/0.52×0.25=12。反应物化学计量数之和大于产物计量数之和,压缩体积,平衡向正反应方向移动。(4)32gCH3OH为1mol,产物中H2O为2mol,由H2O(l)= H2O(g);ΔH=+44 kJ/mol。故热化学方程式为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-281kJ/mol。 CH3OH(g)可知,消耗n(CO):n(H2)=1:2,故消耗H2的物质的量为0.75mol×2=1.5mol,达到平衡时剩余H2的物质的量为2mol-1.5mol=0.5mol。故浓度为 0.5mo/L。该温度下化学平衡常数为0.75/0.52×0.25=12。反应物化学计量数之和大于产物计量数之和,压缩体积,平衡向正反应方向移动。(4)32gCH3OH为1mol,产物中H2O为2mol,由H2O(l)= H2O(g);ΔH=+44 kJ/mol。故热化学方程式为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-281kJ/mol。
考点:化学平衡图像,热化学方程式书写,化学平衡常数考查。
本题难度:困难
3、简答题 写出下列热化学方程式
(1)已知25℃、101kpa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.写出25℃、101kPa时的辛烷燃烧热的热化学方程式______.
(2)在一定条件下,N2和H2完全反应生成1molNH3放热46.0kJ热量.写出氨分解为氢气和氮气的热化学方程式______.
参考答案:(1)25℃、101kpa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量,114g辛烷完全燃烧生成二氧化碳和液态水放出热量5517.6KJ/mol,反应的热化学方程式为:C8H18(l)+252O2(g)=8CO2(g)+9H2O(g)△H=-5517.6KJ/mol,
故答案为:C8H18(l)+252O2(g)=8CO2(g)+9H2O(g)△H=-5517.6KJ/mol;
(2)N2和H2完全反应生成1molNH3放热46.0kJ热量,生成2mol氨气放热92KJ,氨气分解为吸热反应,反应的焓变为+92KJ,反应的热化学方程式为:2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol;
故答案为:2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol.
本题解析:
本题难度:一般
4、填空题 写出298K时,下列反应的热化学方程式
(1)28g?CO还原Fe2O3生成单质铁,放出8.3kJ热量;______
(2)N2和O2化合生成184g?NO2气体,吸收热量135.4kJ;______.
参考答案:(1)n(CO)=28g28g/mol=1mol,则3molCO反应放出的热量为3×8.3kJ=24.9kJ,
所以反应的热化学方程式为:3CO(g)+Fe2O3(s)═2Fe(s)+3CO2(g)△H=-24.9KJ/mol.
故答案为:3CO(g)+Fe2O3(s)═2Fe(s)+3CO2(g)△H=-24.9KJ/mol;
(2)反应的方程式为:N2+2O2═2NO2,n(NO2)=184g46g/mol=4mol,则生成2molNO2吸收12×135.4kJ=67.7kJ,
所以反应的热化学方程式为N2(g)+2O2(g)═2?NO2(g)△H=+67.7kJ/mol,
故答案为:N2(g)+2O2(g)═2?NO2(g)△H=+67.7kJ/mol.
本题解析:
本题难度:简单
5、填空题 (10分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1) 实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则甲醇的燃烧热ΔH= 。
(2)今有如下两个热化学方程式:
参考答案:
本题解析:
本题难度:一般
|