微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)回答下列问题:
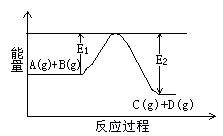
(1)反应A(g)+B(g) C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
或“无法确定”)。
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)=" CO" (g)+ H2O (g) △H1=" +34.0" kJ/mol
甲酸(g)= CO2 (g)+ H2(g) △H2=" —7.0" kJ/mol
则甲酸的分子式为 ,在该条件下,气态CO2和气态H2反应生成气态CO和气态H2O的热化学方程式为 。
(3)如图所示,水槽中试管内有一枚铁钉,放置数天观察:

I若试管内液面上升,则正极反应: 。
II若试管内液面下降,则发生 腐蚀。
III若溶液甲为水,溶液乙为海水,则铁钉在 (填“甲”或“乙”)溶液中腐蚀的速度快。
参考答案:(10分)(1)<。(1分)
(2)CH2O2(1分),CO2(g) + H2(g) =" CO(g)" + H2O(g) △H = +41.0kJ/mol。(2分)
(3)IO2 + 2H2O + 4e-→ 4OH- 。(2分)II析氢。(2分)III乙。(2分)
本题解析:略
本题难度:一般
2、填空题 (1) 在一定温度下,测得0.1 mol·L-1CH3COOH溶液的PH为3.0。则CH3COOH在水中的电离为 ,此温度CH3COOH的电离平衡常数为 。
(2) 在25℃时,Kw=1.0×10-14,测得0.1 mol·L-1 Na2A溶液的pH=7。则H2A在水溶液中的电离方程式为 ,该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH= 。
(3) 已知HCN(aq)+NaOH(aq)=NaCN(aq)+ H2O(l) ΔH=-12.1 kJ·mol-1;
HCl(aq) +NaOH(aq)=NaCl(aq) + H2O(l) ΔH=-57.3 kJ·mol-1。
则在水溶液中HCN H++CN-电离的ΔH为 kJ·mol-1
H++CN-电离的ΔH为 kJ·mol-1
参考答案:(1) 1% 10-5 (2) H2A=2H++A2- 3 (3) +45.2
本题解析:(1)CH3COOH CH3COO-+H+。PH=3.0,C(H+)=10-3mol/LC(CH3COOH)=0.1mol/L所以CH3COOH在水中的电离度为10-3mol/L÷0.1mol/L×100%=1%.在此温度下CH3COOH的电离平衡常数为(10-3mol/L)2/0.1mol/L=10-5mol/L.(2) 在25℃时,Kw=1.0×10-14,测得0.1 mol·L-1 Na2A溶液的pH=7,说明H2A是强酸。所以H2A在水溶液中的电离方程式H2A=2H++A2-。将0.01 mol·L-1 H2A溶液稀释到20倍后,则C(H+)=(2×0.01mol/L)÷20=0.001mol/L,所以溶液的pH=3。(3)若HCN为强酸,则它与NaOH反应产生1mol的水放出热量也是57.3 kJ·mol-1。现在放出热量12.1 kJ·mol-1,比强酸与氢氧化钠反应放出的热量少45.2KJ/mol.,说明在水溶液中HCN电离吸收热量为45.2KJ/mol.所以HCN
CH3COO-+H+。PH=3.0,C(H+)=10-3mol/LC(CH3COOH)=0.1mol/L所以CH3COOH在水中的电离度为10-3mol/L÷0.1mol/L×100%=1%.在此温度下CH3COOH的电离平衡常数为(10-3mol/L)2/0.1mol/L=10-5mol/L.(2) 在25℃时,Kw=1.0×10-14,测得0.1 mol·L-1 Na2A溶液的pH=7,说明H2A是强酸。所以H2A在水溶液中的电离方程式H2A=2H++A2-。将0.01 mol·L-1 H2A溶液稀释到20倍后,则C(H+)=(2×0.01mol/L)÷20=0.001mol/L,所以溶液的pH=3。(3)若HCN为强酸,则它与NaOH反应产生1mol的水放出热量也是57.3 kJ·mol-1。现在放出热量12.1 kJ·mol-1,比强酸与氢氧化钠反应放出的热量少45.2KJ/mol.,说明在水溶液中HCN电离吸收热量为45.2KJ/mol.所以HCN H++CN-电离的ΔH为+45.2kJ·mol-1。
H++CN-电离的ΔH为+45.2kJ·mol-1。
考点:考查弱电解质的电离度、电离平衡常数及溶液稀释问题的知识。
本题难度:一般
3、填空题 丙烷燃烧可以通过以下两种途径:
(1)途径I:4?.4g丙烷完全燃烧生成CO2和液态水并放出热量为a?kJ,写出丙烷燃烧的热化学方程式___________________________。
(2)途径II:等量丙烷按下列反应进行:
C3H8(g)?==C3H6(g)+?H2(g)?ΔH=+b?kJ·mol-1
2C3H6(g)+?9O2(g)?==?6CO2(g)?+6H2O(l)?ΔH=-c?kJ·mol-1
2H2(g)+O2(g)?==?2H2O(l)?ΔH=-d?kJ·mol-1?(abcd均为正值)
请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量______(填“大于”、“等于”或“小于”)途径II放出的热量?
②由于C3H8(g)?==C3H6(g)+?H2(g)?的反应中,反应物具有的总能量______(填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时。反应物就需要______(填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是______________?
③b?与a、c、d的数学关系式是______________?
参考答案:(1)C3H8(g) + 5O2(g) == 3CO2(g) +4H2O(l)?△H=-10a kJ·mol-1
(2)①等于;②小于;吸收;加热;③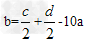
本题解析:
本题难度:一般
4、填空题 (12分)(1)已知N≡N、N—H、H—H的键能分别为946kJ·mol-1、390.8kJ·mol-1、436.0kJ·mol-1。试根据盖斯定律,写出合成氨反应的热化学方程式 。
(2)在通常状况下,足量氢氧化钠的稀溶液与含溶质为1mol的稀硫酸完全反应时放出akJ的热量,写出该反应中和热的热化学方程式____________。
(3)以镁和铝为电极,以NaOH作电解质溶液,构成原电池时,铝做 极,电极反应式为 ;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_______________,该电池总反应的离子方程式为_____________。
参考答案:(12分)
(1)N2(g)+3H2(g) 2NH3 (g) △H =-90.8kJ/mol
2NH3 (g) △H =-90.8kJ/mol
(2)NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+ H2O(l) △H=-a/2kJ/mol
(3)负极;Al-3e+4OH-=2H2O+AlO2- FeO42-+3e-+4H2O=Fe(OH)3+5OH-
3Zn+2FeO42-+8H2O=2Fe(OH)3+4OH-+3Zn(OH)2
本题解析:(1)化学反应的实质是破坏化学键吸收能量和形成化学键释放能量的过程,根据化学反应N2(g)+3H2(g) 2NH3,破坏化学键吸收的能量为946kJ·mol-1+3×436.0kJ·mol-1="2254" kJ·mol-1,形成化学键释放的能量为390.8kJ·mol-1×6=2344.8kJ·mol-1,则热量变化为2254 kJ·mol-1-2344.8kJ·mol-1=-90.8kJ/mol,合成氨反应的热化学方程式为N2(g)+3H2(g)
2NH3,破坏化学键吸收的能量为946kJ·mol-1+3×436.0kJ·mol-1="2254" kJ·mol-1,形成化学键释放的能量为390.8kJ·mol-1×6=2344.8kJ·mol-1,则热量变化为2254 kJ·mol-1-2344.8kJ·mol-1=-90.8kJ/mol,合成氨反应的热化学方程式为N2(g)+3H2(g) 2NH3 (g) △H =-90.8kJ/mol。
2NH3 (g) △H =-90.8kJ/mol。
(2)中和热是指强酸强碱的稀溶液反应生成1mol水时放出的热量,1mol的稀硫酸完全反应时放出akJ的热量,则生成1mol水时放出的热量为a/2,该反应中和热的热化学方程式为NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+ H2O(l) △H=-a/2kJ/mol。
(3)镁和铝为电极,以NaOH作电解质溶液构成的原电池,铝与氢氧化钠反应,而镁不反应,所以,铝作负极,电极反应式为Al-3e+4OH-=2H2O+AlO2-;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,则FeO42-得电子生成Fe(OH)3和OH-,其电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5OH-,负值是Zn失电子,在碱性溶液中生成Zn(OH)2,电极反应为Zn-2e-+2OH-=Zn(OH)2,再根据正负极转移电子数相等,配平,然后正负极相加得该电池总反应,该电池总反应的离子方程式为3Zn+2FeO42-+8H2O=2Fe(OH)3+4OH-+3Zn(OH)。
考点:考查盖斯定律的应用,中和热及原电池电极反应的书写。
本题难度:一般
5、填空题 (热值指在一定条件下每克物质完全燃烧所放出的热量,燃烧产物在该条件下是一种较为稳定的状态),下表是几种物质在常温常压下的热值数据.
| 物质 | H2 | CO | CH4
|
| 热值/kJ?g-1 | 143 | 10 | 56
|
(1)根据以上热值数据,最理想的燃料是______.
(2)根据以上热值数据,写出在该状态下表达氢气燃烧热的热化学方程式______.
(3)若管道煤气(含体积比为1:1的H2和CO)价格为1.00元/m3,天然气的价格为2.50元/m3,使用哪种气体在经济上更为合算?______?理由是______.(无需写出计算过程)
参考答案:(1)由表中数据可看出H2的热值最大,且H2为绿色能源,无污染,是最理想的燃料,故答案为:H2;
(2)由表中数据可知,1gH2燃烧放出的热量为143kJ,则1molH2放出的热量为:2×143kJ=286kJ,
所以氢气燃烧热的热化学方程式为H2(g)+12O2(g)=H2O(1);△H=-286kJ?mol-1,
故答案为:H2(g)+12O2(g)=H2O(1);△H=-286kJ?mol-1;
(3)设花费相同的价格的燃料,为都2.5元,
则花费2.5元管道煤气放出的热量为:
500L22.4L/mol×2g/mol1g×143kJ/g+500L22.4L/mol×28g/mol1g×10kJ/g=7009kJ;
花费2.5元天然气放出的热量为:1000L22.4L/mol×16g/mol1g×56kJ/g=40000kJ,
则消费相同价格的燃料时天然气放出的热量多,更合算,
故答案为:天然气;相同价格的管道煤气和天然气相比产生的热量后者多.
本题解析:
本题难度:一般