微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、D、E为前四周期中原子序数依次增大的元素,相关的信息如下:
元素
| 相关信息
|
A
| A元素原子核外只有三个能级,且每个能级上含有相等的电子数
|
B
| 是空气中含量最丰富的元素
|
C
| 短周期中,单质C的金属性最强
|
D
| 基态原子第三能层上有7种运动状态不同的电子
|
E
| 一种核素的质量数为63,中子数为34
|
请用对应的元素符号回答下列问题:
(1)A与氢可形成一种的分子式为A2H4化合物,该分子中存在σ键与π键数目比为 。
(2)H—A、H—B两种共价键中,键能较大的是 ;H—A、H—D两种共价键中,键的极性较强的是
(3)E位于周期表中的位置是 ,单质E与B的最高价氧化物的水化物的稀溶液反应的离子方程式为 。
(4)根据下列能量变化示意图,请写出BO和AO2反应的热化学方程式 。

(5)C的最高价氧化物对应的水化物为M,M中含有的化学键类型为 。将一定量的D2通入一定浓度M的水溶液中,两者恰好完全反应时,生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如上图所示。请写出t2时刻总反应方程式
2、填空题 Ⅰ 通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
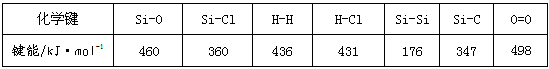
请回答下列问题:?
(1)比较下列两组物质的熔点高低(填“>”或“<”):?SiC________Si;SiCl4________SiO2。
(2)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g)?该反应的反应热ΔH=
Si(s)+4HCl(g)?该反应的反应热ΔH=
__________kJ·mol-1。
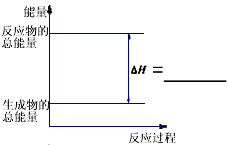
(3)请把下图表示固体Si在O2中完全燃烧生成SiO2固体的能量变化图补充完整。
Ⅱ 某实验小组设计下列实验
A 分别配制250mL 1.0 mol/L盐酸跟和250mL 1.1 mol/L氢氧化钠溶液。
B 每次分别取用上述配制的盐酸50 mL跟和氢氧化钠50 mL进行中和反应,并通过测定反应过程中所放出的热量可计算中和热。
试回答下列问题:?
(4)为进行A步实验时,有实验仪器托盘天平、药匙、小烧杯、玻璃棒、量筒、250mL容量瓶(2个),还缺少的仪器有_____________ 进行B步实验时,有实验仪器大烧杯、小烧杯、量筒(2个)、小烧杯、塑料板、废纸条若干还缺少的实验仪器有_____________
(5)在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H
___________(填“偏大”、“偏小”或“无影响”);
(6)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
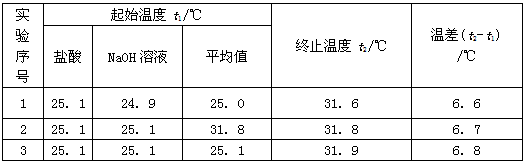
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容C=4.18×10-3kJ/(g·℃),则该反应的热化学反应方程式为____________________________。
3、填空题 (14分)
(1)纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)= ;
若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)= 。
(2)在CH3COONa的溶液中,各离子的物质的量浓度由大到小的顺序是 来源:91 考试网; 。
(3)明矾的水溶液显酸性,其原因是(用离子方程式表示) 。
(4)在25℃、101kPa下,0.5mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为 。
(5)1L 1 mol·L-1 H2SO4溶液与2L 1 mol·L-1 NaOH溶液完全反应,放出114.6kJ热量,则表示中和热的热化学方程式为 。
(6)已知:①N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol ;
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
则N2H4与NO2与完全反应生成氮气和气态水的热化学方程式为 。
4、选择题 下列说法正确的是( )
A.热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
C.书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态
D.凡是化合反应都是放热反应,分解反应都是吸热反应
5、选择题 含NaOH 20.0g的稀溶液与足量的稀盐酸反应,放出28.7kJ的热量,表示该反应的热化学方程式是( )
A.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+28.7kJ/mol
B.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-28.7kJ/mol
C.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.4kJ/mol
D.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.4kJ/mol