微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把某表面被氧化的钢铁样品,加入过量稀H2SO4中,过滤,除去杂质,在滤中滴加KSCN溶液无血红色,继续向滤液中加入适量硝酸后,再加入过量的氨水,有沉淀生成.上述作过程中加入硝酸之前溶液中的溶质和最终生成的沉淀颜色分别为( )
A.Fe2(SO4)3;白色
B.Fe2(SO4)3;红褐色
C.FeSO4;红褐色
D.FeSO4;色→灰绿色→红褐色
参考答案:C
本题解析:
本题难度:一般
2、选择题 76.8mg铜与适量浓硝酸反应,铜全部作用后,如果NO3-离子减少2×10-3mo l,则溶液中H+离子同时减少?(?)
l,则溶液中H+离子同时减少?(?)
A.4.8×10-3mol
B.4.4×10-3mol
C.3.2×10-3mol
D.2.2×10-3mol
参考答案:B
本题解析:略
本题难度:简单
3、简答题 工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝.工艺流程如下图:
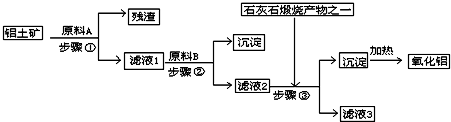
(1)原料A的名称是______,步骤①反应的离子方程式是______.
(2)滤液1中要加入稍过量原料B,原料B的化学式是______,步骤②反应的离子方程式是:______.
(3)步骤③的化学方程式是:______.
(4)如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,则会对氧化铝的提取有什么影响______.
参考答案:由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液②含有AlO2-.步骤②应加入氢氧化钠,所以滤液①中含有Al3+,步骤①应为加入盐酸,除去SiO2.
(1)由上述分析可知,步骤①加入盐酸,除去SiO2,所以原料A为盐酸,
氧化铝与酸反应离子方程式为Al2O3+6H+=2Al3++3H2O,氧化铁与盐酸反应离子方程式为Fe2O3+6H+=2Fe3++3H2O.
故答案为:Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O.
(2)步骤①加入过量盐酸,滤液①中含有Al3+、Fe3+、H+等,应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,反应为?H++OH-=H2O,Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O.
故答案为:NaOH;?H++OH-=H2O、Fe3++3OH-=Fe(OH)3、Al3++4OH-=AlO2-+2H2O.
(3)滤液②含有AlO2-,步骤③通入二氧化碳,与AlO2-反应生成的沉淀为氢氧化铝,
反应化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
故答案为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
(4)若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,通入二氧化碳会生成硅酸沉淀,最后使加热制得的Al2O3混有SiO2杂质.
故答案为:若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质.
本题解析:
本题难度:一般
4、简答题 某研究性学习小组用不纯的氧化铝(杂质为Fe2O3)为原料,设计了冶炼铝的以下工艺流程(部分反应产物没有标出):
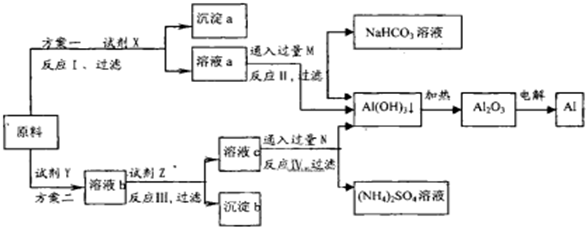
(1)试剂X的化学式为______,反应I的离子方程式是______.
实验室配制480mL?1mol?L-1?X的溶液必须用到玻璃仪器除烧杯、玻璃棒、试剂瓶、胶头滴管外,还有______.常用来可以标定所配X的溶液浓度是否准确的实验名称是______.
(2)按照方案设计,试剂Z的作用是调节溶液的pH,以生成沉淀b[Fe(OH)3].从实际工业的角度,你认为方案______更合理,理由是______
(3)已知N为氨气,实验室中还可以用下图装置制取氨气并进行氨气喷泉实验.
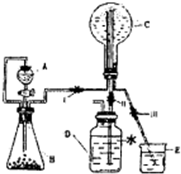
①仪器A的名称是______,装置中A口部和B口部之间联通导气管的作用是______
②若用此装置制备N气,若A中盛有浓氨水,则B装置中的固体试剂不可以选用下列的______(填字母序号).
A.生石灰?B.烧碱?C.胆矾?D.碱石灰
(4)若D中事先滴入少量酚酞,则C中液体呈______色,用离子方程式解释原因______.
参考答案:(1)方案一:由溶液a通入过量的M生成氢氧化铝沉淀、碳酸氢钠可知,溶液a中含有偏铝酸根、气体M为二氧化碳,故试剂X为NaOH溶液,反应I为氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水,离子方程式为:Al2O3+2OH-═2AlO2-+H2O,
实验室没有480mL容量瓶,应选择500mL容量瓶,配制500mL1mol?L-1?NaOH的溶液需要玻璃仪器有:烧杯、玻璃棒、试剂瓶、胶头滴管、500mL容量瓶,故缺少500mL容量瓶,
可以利用中和滴定方法以标定所配NaOH溶液浓度是否准确;
故答案为:NaOH;Al2O3+2OH-═2AlO2-+H2O;500mL容量瓶;中和滴定;
(2)方案二:由溶液c通入过量的N生成氢氧化铝沉淀、硫酸铵可知,溶液c中含有铝离子、N为氨气,故试剂Y为硫酸,溶液b中含有硫酸铝、硫酸铁,调节PH值,是铁离子转化为氢氧化铁,过滤后,再向滤液中加入过量的氨水沉淀铝离子,
与方案一相比较,方案一步骤少,操作简单,故方案一更合理,
故答案为:方案一;步骤少,操作简单;
(3)①、仪器A是分液漏斗,装置中A口部和B口部之间联通导气管的作用是:平衡分液漏斗内外压强,防止分液漏斗堵塞;
②、A中盛有浓氨水,与生石灰、烧碱、碱石灰混合,放出大量的热,溶液中氢氧根离子浓度增大,利用氨气逸出,产生大量的氨气,氨水与胆矾反应生成氢氧化铜沉淀,不能产生氨气,故C不能可以,
故答案为:C;
(4)氨气溶于水,反应生成一水合氨,一水合氨电离出氢氧根,NH3+H2O?NH3?H2O?NH4++OH-,溶液呈碱性,酚酞在碱性条件下呈红色,
故答案为:红;NH3+H2O?NH3?H2O?NH4++OH-.
本题解析:
本题难度:一般
5、简答题 Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程为:______.为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备.
(1)用硫酸亚铁晶体配制上述FeSO4溶液时你觉得还需加入______.(2)除去蒸馏水中溶解的O2常采用______的方法.
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是______.
(4)检验Fe3+存在的最佳试剂是______,现象是______.
(5)写出Fe与H20在一定条件下反应的化学方程式______.
参考答案:Fe(OH)2被氧化的化学方程为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(1)FeSO4溶液中亚铁离子易被氧化为三价铁离子,加入铁粉可以防止被氧化,故答案为:铁粉;
(2))氢氧化亚铁的制备要隔绝空气,除去蒸馏水中溶解的O2常采用加热至沸腾的方法,故答案为:铁粉;加热至沸腾;
(3)长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,可以防止空气随着NaOH溶液的加入进入溶液,故答案为:可以防止空气随着NaOH溶液的加入进入溶液;
(4)用KSCN来检验三价铁离子,现象为溶液变为血红色,故答案为:KSCN溶液;溶液变为血红色;
(5)Fe与H20在一定条件下反应的化学方程式:3Fe+4H20(g)?高温?.?Fe3O4+4H2,故答案为:3Fe+4H20(g)?高温?.?Fe3O4+4H2.
本题解析:
本题难度:一般