| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《原电池原理》试题强化练习(2017年最新版)(二)
参考答案:(1)①NH4Cl(或氯化铵)溶液 ②2MnO2+2NH4++2e-=Mn2O3+H2O+2NH3 ③正极 本题解析:(1)该电池的工作原理:负极失去电子被氧化,正极上富集电子,阳离子向正极移动。(2)从影响化学反应速率的角度考虑,构成原电池能加快负极失电子。 本题难度:一般 3、选择题 有a、b、c、d四种金属,将a与b用导线连结起来浸入某电解质溶液中,a溶解。将a、d分别投入等浓度的盐酸中,d比a反应剧烈。将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,Cu上有c的单质析出,据此判断它们的活动性由强到弱的顺序是 参考答案:A 本题解析: 本题难度:一般 4、选择题 如图为一原电池装置,其中X、Y为两电极.对此装置的下列说法中正确的是( ) |
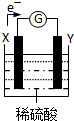
参考答案:A.由电子的流动方向可知X为原电池的负极,Y为原电池的正极,负极为较活泼金属,若两电极都是金属,则它们的活动性顺序为:X>Y,故A正确;
B.电流的方向和电子的方向相反,应为Y→外电路→X,故B错误;
C.若两电极分别为锌棒和石墨棒,则X为锌棒,为负极,故C错误;
D.Y为正极,发生还原反应,故D错误.
故选A.
本题解析:
本题难度:简单
5、选择题 用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ? ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)?ΔH2=-1 160 kJ·mol-1
若在标准状况下用CH4还原4.48 L NO2生成N2,则下列说法中正确的是
( )。
A.该过程吸收的热量为86.7 kJ
B.此过程中需要标准状况下CH4气体1.12 L
C.转移的电子数为0.8NA
D.已知2NO(g)+O2(g)=2NO2(g) ΔH=-114 kJ·mol-1,则CH4的燃烧热是802 kJ·mol-1
参考答案:C
本题解析:根据盖斯定律将两个热化学方程式相加并除以2可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH2=-867 kJ·mol-1,为放热反应,A项错误;B项计算错误,应需要标准状况下2.24 L CH4;表示甲烷燃烧热必须是生成液态水,由所给条件不能计算,故D项错误。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《铵盐》高频.. | |