微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车。总反应方程式如下:
Ni(OH)2+M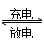 NiOOH+MH,下列叙述正确的是
NiOOH+MH,下列叙述正确的是
A.放电时正极附近溶液的碱性增强
B.放电时负极反应为:M+H2O+e-===MH+OH-
C.放电时阳极反应为:NiOOH+H2O+e-===Ni(OH)2+OH-
D.放电时每转移1 mol电子,正极有1 mol NiOOH被氧化
参考答案:A
本题解析:放电相当于原电池,C不正确。正极是得到电子的,根据总反应式可知,正极是NiOOH中的Ni得到电子被还原,生成Ni(OH)2,碱性增强,A正确,D不正确。原电池中负极失去电子,因此选项B不正确。答案选A。
本题难度:一般
2、选择题 铜锌原电池(如右图)工作时,下列叙述错误的是
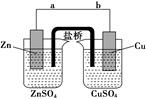
A.盐桥中的K+移向ZnSO4溶液
B.电池总反应为:Zn+Cu2+==Zn2++Cu
C.在外电路中,电子从负极流向正极
D.负极反应为:Zn-2e-==Zn2+
参考答案:A
本题解析:A项:在溶液中,阳离子往正极移动,K+移向CuSO4溶液,故A错误。故选A。
点评:本题考查原电池原理,盐桥在原电池中的作用是代替了单一溶液体系,电子的流向问题是学生普遍感到困难的一个考点。
本题难度:简单
3、填空题 (7分)“阿波罗号飞船”所用的氢氧燃料电池的电极应为:负极:2H2+4OH--4e-=4H2O,则正极反应为?;该电池工作时,通氢气的一极发生?反应(填氧化、还原),每转移4摩电子,电池内增加?摩水,负极附近溶液的PH值?,(填升高、降低、不变),正极附近? [H+]?(填升高、降低、不变)
参考答案:(7分)
正极反应为O2+2H2O+4e-=4OH-(2分),还原(1分),2(2分),降低(1分)降低(1分)
本题解析:略
本题难度:简单
4、填空题 铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。指出电解质溶液是__________,正极电极反应式为__________________。
(3)写出甲醇(CH3OH)—空气碱性燃料电池(KOH作为电解质溶液)的负极反应式:_______________________________。
参考答案:(1)2Fe3++Cu=2Fe2++Cu2+;(2分)
(2)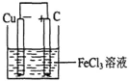 (2分) ;
(2分) ;
FeCl3(1分); 2Fe3++2e—=2Fe2+。(2分)
(3) CH3OH-6e-+8OH-=CO32-+6H2O (3分)
本题解析:(1)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为 ,故答案为:
,故答案为: ;Cu-2e-=Cu2+;
;Cu-2e-=Cu2+;
Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)。
(3)甲醇是负极,失去电子,电极式为CH3OH-6e-+8OH-=CO32-+6H2O。
考点:盐和亚铁盐的相互转变 电极反应和电池反应方程式.
点评:本题考查了原电池的工作原理及原电池的设计,难度较大,原电池的设计是学习的重点和难度。
本题难度:一般
5、选择题 下列叙述中正确的有
①燃烧热是指1 mol可燃物完全燃烧生成氧化物时所释放的能量
②某反应的△H=+100kJ/mol,可知该反应的正反应活化能比逆反应活化能大100kJ/mol
③碳酸铵在室温条件下能自发分解产生氨气,是因为生成了气体,体系的熵增大
④强电解质水溶液的导电能力一定比弱电解质水溶液的导电能力强
⑤Mg比Al活泼,在Mg和Al形成的原电池中,Mg必定做负极
⑥轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法进行保护
A.3
B.4
C.5
D.6
参考答案:A
本题解析:燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,①不正确;某反应的△H=+100kJ/mol,则该反应是吸热反应,所以该反应的正反应活化能比逆反应活化能大100kJ/mol,②正确;碳酸铵在室温条件下能自发分解产生氨气,而该反应是吸热反应,则根据△G=△H-T·△S可知,体系的熵增大,③正确;溶液导电性强弱只与溶液中离子浓度及离子所带电荷数有关系,所以强电解质水溶液的导电能力不一定比弱电解质水溶液的导电能力强,④不正确;Mg比Al活泼,在Mg和Al形成的原电池中,Mg不一定做负极,例如如果用氢氧化钠溶液做电解质溶液,则铝是负极,镁是正极,⑤不正确;锌的金属性强于铁,与铁构成原电池时锌是负极,铁是正极,被保护。所以轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法进行保护法,⑥正确,答案选A。
本题难度:一般