微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某恒容容器内发生的可逆反应的化学平衡常数表达式为: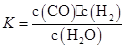 。能判断该反应一定达到化学平衡状态的依据是(? )
。能判断该反应一定达到化学平衡状态的依据是(? )
①容器中气体的平均相对分子质量不随时间而变化
②v正(H2O)=v逆(H2)
③容器中气体的密度不随时间而变化
④容器中气体总质量不随时间而变化
⑤消耗n mol H2的同时消耗n mol CO
A.①②③
B.①②③④
C.②
D.①④⑤
参考答案:B
本题解析:根据平衡常数可知,该可逆反应为C(s)+H2O(g) CO(g)+H2(g),因为C为固体,没有达到平衡,则混合气体的平均相对分子质量一直在发生变化,平均相对分子质量不变,说明反应已经达到平衡,①对;v正(H2O)=v逆(H2)说明反应达到平衡,②对;虽然容器的体积不变,但是气体的质量可变,当气体的密度不变时,说明反应达到了平衡状态, ③对、④对;任何时刻消耗n mol H2的同时都消耗n mol CO,⑤错,正确选项为B。
CO(g)+H2(g),因为C为固体,没有达到平衡,则混合气体的平均相对分子质量一直在发生变化,平均相对分子质量不变,说明反应已经达到平衡,①对;v正(H2O)=v逆(H2)说明反应达到平衡,②对;虽然容器的体积不变,但是气体的质量可变,当气体的密度不变时,说明反应达到了平衡状态, ③对、④对;任何时刻消耗n mol H2的同时都消耗n mol CO,⑤错,正确选项为B。
本题难度:一般
2、选择题 对于x A(g) + y B(g) 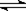 ?z C(g)+ w D(g)的平衡体系,当升高温度时,体系的压强降低,下列说法中正确的是(?)
?z C(g)+ w D(g)的平衡体系,当升高温度时,体系的压强降低,下列说法中正确的是(?)
A.x+y>z+w ,正反应是放热反应
B.x+y>z+w ,正反应是吸热反应
C.x+y<z+w ,逆反应是放热反应
D.x+y>z+w ,逆反应是吸热反应
参考答案:B
本题解析:如果正反应是放热反应,则升高温度,平衡向逆反应方向移动。要使体系的压强降低,则气体的体积应该是减小的,即正反应使体积增大的,所以选项A、D不正确;如果正反应是吸热反应,则升高温度,平衡向正反应方向进行,则正反应一定是体积减小的,选项B正确,C不正确,所以答案选B。
本题难度:一般
3、填空题 (18分)能源的开发和利用是当前科学研究的重要课题。
(1)利用二氧化铈(CeO2)在太阳能作用下前实现如下变废为宝的过程:
mCeO2 ?(m-x)CeO2
?(m-x)CeO2 xCe+xO2
xCe+xO2
(m-x)CeO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2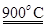 mCeO2+xH2+xCO
mCeO2+xH2+xCO
上述过程的总反应是?,该反应将太阳能转化为?。
(2)CO、O2和KOH溶液构成的燃料电池的负极电极反应式为?。该电池反应可获得K2CO3溶液,某温度下0.5mol L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O
L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O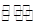 HCO3-+OH-的平衡常熟Kh= ?。
HCO3-+OH-的平衡常熟Kh= ?。
(3)氯碱工业是高耗能产业,下列将电解池与燃料电池相组合的工艺可以节能30%以上。

①电解过程中发生反应的离子方程式是?,阴极附近溶液PH?(填“不变”、“升高”或“下降”)。
②如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,该钡试剂可选用下列试剂中的?。
a.Ba(OH)2 ?b.Ba(NO3)2? c.BaCl2
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式?。
③图中氢氧化钠溶液的质量分数a%?b%(填“>”、‘‘=”或“<”),,燃料电池中负极上发生的电极反应为?。
参考答案:(18分)
(1)H2O + CO2 =H2 + CO + O2(2分)?化学能(1分)
(2)CO – 2e- +4OH- = CO32- + 2H2O(2分)? 2×10-4 mol·L-1(2分)
(3)①2Cl-+2H2O  ?Cl2↑+ H2↑+2OH-(2分)?升高(1分)?
?Cl2↑+ H2↑+2OH-(2分)?升高(1分)?
②? ac(2分)? BaCO3(s)+ SO42-(aq) = BaSO4 (s)+ CO32-(aq)(2分)
③? <(2分)? H2-2e-+2OH-=2H2O?(2分)
本题解析:(1)两式相加可得总反应方程式:H2O + CO2 =H2 + CO + O2;通过该反应把太阳能转化为了化学能。
(2)在碱性条件下,CO失电子转化为CO32?,电解方程式为:CO – 2e- +4OH- = CO32- + 2H2O;溶液的pH=12,则c(OH?)=0.01mol?L?1,若忽略CO32-的第二级水解,c(HCO3?)=0.01mol?L?1,则Kh=c(HCO3?)?c(OH?)/c(CO32?)= 0.01mol?L?1×0.01mol?L?1/0.5mol?L?1= 2×10-4 mol·L-1。
(3)①电解食盐水生成H2、H2和NaOH,所以离子方程式为:2Cl-+2H2O  ?Cl2↑+ H2↑+2OH-;阴极上H2O电离出的H+得电子生成H2,使H2O的电离平衡向右移动,OH?浓度增大,所以pH升高。
?Cl2↑+ H2↑+2OH-;阴极上H2O电离出的H+得电子生成H2,使H2O的电离平衡向右移动,OH?浓度增大,所以pH升高。
②Ba(OH)2可与SO42?反应,OH?可加盐酸除去,BaCl2可与SO42?反应,而且不引入新杂质,Ba(NO3)2能与SO42?反应,但NO3?无法除去,故ac正确;BaCO3转化为更难溶的BaSO4,离子方程式为:BaCO3(s)+ SO42-(aq) = BaSO4 (s)+ CO32-(aq)。
③在燃料电池中,氧气作正极,所以通入空气的极是正极,O2得电子生成OH?,通入燃料的电极是负极,消耗OH?,所以a% < b%;负极是燃料氢气发生失电子的氧化反应,电极反应式为H2-2e-+2OH-=2H2O。
本题难度:一般
4、选择题 下列事实不能用勒夏特列原理解释的是
A.新制的氯水在光照条件下颜色变浅
B.开启啤酒瓶后,瓶中立刻泛起大量泡沫
C.高锰酸钾(KMnO4)溶液加水稀释后颜色变浅
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
参考答案:C
本题解析:试题分析:能用勒夏特列原理解释的是存在化学平衡的反应,且化学平衡要发生移动。KMnO4溶液加水稀释后溶液变浅不存在平衡,所以不能用勒夏特列原理解释。答案选C。
考点:化学平衡移动
点评:勒夏特列原理是改变影响平衡移动的一个因素,平衡向减弱这种改变的方向移动。
本题难度:困难
5、填空题 (8分)在2 L密闭容器内,800 ℃时反应2N O(g)+O2(g)
O(g)+O2(g)  2NO2(g)(正反应为放热反应)体系中,n(NO)随时间的变化如下表:
2NO2(g)(正反应为放热反应)体系中,n(NO)随时间的变化如下表:
时间(s)
| 0
| 1
| 2
| 3
| 4
| 5
|
n(NO)(mol)
| 0.020
| 0.010
| 0.008
| 0.007
| 0.007
| 0.007
|
?(1)如图中表示NO2变化曲线的是 .用O2表示从0 s~2 内 该反应的平均速率v= . mol/(L·s)
该反应的平均速率v= . mol/(L·s)
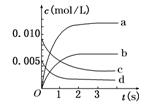
(2)能说明该反应已达到平衡状态的是 .
a.v(NO2)=2v(O2)? b.容器内压强保持不变
c.v(NO)逆=2v(O2)正? d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是 .
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度? d.选择高效催化剂
参考答案: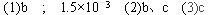
本题解析:略
本题难度:一般