微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的相对分子质量与X最最高价氧化物的相对分子质量之比为17∶ 40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne相同,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子。试回答:
(1)写出各元素名称:X?、Y?、Z?。
(2)X与Y形成的离子化合物的电子式为 ______ ?,Z的单质通入澄清石灰水反应的离子方程式是? _____?。
(3)Y单质在空气中燃烧产物与水反应的化学方程式为____________________。
参考答案:(1)硫,钠,氯(写元素符号不得分)
(2)Na+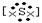 2-Na+, ?CI2 +? +2OH- ="=" CI- + CIO- + H2O(写化学方程式不得分)
2-Na+, ?CI2 +? +2OH- ="=" CI- + CIO- + H2O(写化学方程式不得分)
(3)2Na2O2 + 2H2O =" 4NaOH" + O2↑
本题解析:X最高价氧化物化学式为XO3,设X的相对原子质量为X,
则(2+X):(X+48)= 17∶ 40,得:X=32,
“X原子核内质子数与中子数相等”,则X为硫元素;
由“Y2X”,得:Y形成+1价阳离子,“Y的阳离子电子层结构与Ne相同”,所以Y是钠元素;
由题意,得:Z是氯元素;
本题难度:简单
2、选择题 下列结论正确的是:?
①粒子半径:S2->Cl>S;?②氢化物稳定性:HF>HCl>PH3;
③离子还原性:S2->Cl->Br->I-;④单质氧化性:Cl2>S;⑤酸性:H2SO4>HClO4; ⑥碱性强弱:KOH>NaOH>Mg(OH)2。
A.①
B.③⑥
C.②④⑥
D.①③④
参考答案:C
本题解析:粒子半径:S2->S>Cl,氢化物稳定性:HF>HCl>PH3离子还原性:Cl-<Br-<I-
①③错误。单质氧化性:Cl2>S,酸性:H2SO4<HClO4;碱性强弱:KOH>NaOH>Mg(OH)2。
本题难度:一般
3、填空题 已知某粒子的结构示意图为: 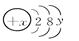
试回答:
(1)当x-y=10时,该粒子为________(填“原子”、“阳离子”或“阴离子”)。
(2)当y=8时,粒子可能为(填名称):
________、________、________、________、________。
(3)写出y=2的元素的碱与y=6的元素的最高价含氧酸发生反应的化学方程式________________________________________________________________________。
参考答案:(1)原子? (2)硫离子、氯离子、钾离子、钙离子、氩原子
(3)MgOH)2+H2SO4=MgSO4+2H2O
本题解析:(1)当x-y=10时,说明该微粒是不带电荷的,属于原子。
(2)当y=8时,说明核外电子数是18,则粒子可能为硫离子、氯离子、钾离子、钙离子、氩原子。
(3)y=2的元素的碱是氢氧化镁,y=6的元素的最高价含氧酸是硫酸,二者发生反应的化学方程式MgOH)2+H2SO4=MgSO4+2H2O。
点评:该题是中等难度的试题,也是高考中的常见题型。试题设计新颖,基础性强。旨在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是明确元素核外电子排布的规律,然后结合题意灵活运用即可。
本题难度:一般
4、填空题 (6分)A元素原子M电子层上有6个电子。B元素与A元素的原子核外电子层数相同,B元素的原子最外电子层只有1个电子。
(1)B元素的原子结构示意图为___________
(2)A、B两元素形成的化合物的名称是________?
(3)用电子式表示B2A的形成过程?
参考答案:
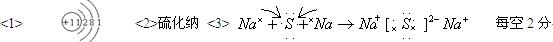
本题解析:略
本题难度:一般
5、选择题 下列各组元素中,属于同一周期的是
A.碳、氧、硫
B.硅、磷、氯
C.锂、钠、钾
D.氟、氯、溴
参考答案:B
本题解析:考查元素周期表的结构。元素的周期数就是元素原子的电子层数,硅、磷、氯原子核外均有3层,属于第三周期,所以答案选B。
本题难度:简单