微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各选项中,后者不属于前者的是
A.酸、硫酸
B.碳酸盐、Na2CO3
C.化合物、氧化物
D.钾盐、KOH
参考答案:D
本题解析:分析:A、酸指电离时产生的阳离子全部都是氢离子的化合物;
B、盐指电离时生成金属阳离子(或NH4+)和酸根离子的化合物,碳酸盐电离出碳酸根;
C、化合物指由两种或两种以上的元素组成的纯净物;氧化物是负价氧和另外一个化学元素组成的二元化合物;
D、钾盐为电离出钾离子与酸根离子的化合物.
解答:A、硫酸电离出氢离子与硫酸根离子,属于酸,故A正确;
B、碳酸钠电离出钠离子与碳酸根离子,属于碳酸盐,故B正确;
C、氧化物是负价氧和另外一个化学元素组成的二元化合物,属于化合物,故C正确;
D、氢氧化钾电离出钾离子与氢氧根离子,属于碱,故D错误.
故选D.
点评:本题主要考查物质的分类方法,解答时要分析物质的元素组成和物质组成,然后再根据各类物质概念的含义进行分析、判断,从而得出正确的结论
本题难度:困难
2、选择题 下列说法正确的是
A.酸只有一种分类方法,可分为含氧酸和无氧酸
B.碱只有两种分类方法,可分为强碱和弱碱,也可分为一元碱、二元碱等
C.氧化物不可进一步分类
D.树状分类法和交叉分类法都是常用分类方法
参考答案:D
本题解析:分类的标准和方法不同,得到的结论也不相同,对物质和化学反应也是这样,每一类物质一般都有许多分类方法,A、B、C选项都是错误的,D选项正确.
本题难度:简单
3、填空题 (8分)在下列各组物质中,找出合适的序号填在对应的空格内:
①NO2和N2O4 ?②12C和14C? ③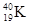 和
和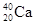
④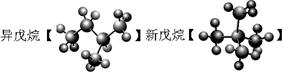
⑤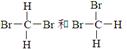
⑥甲烷与丙烷]
⑦乙醇(CH3CH2OH)和乙二醇(HO—CH2—CH2—OH)
(1)互为同位素的是 ;
(2)互为同分异构体的是 ;
(3)互为同系物的是 ;
(4)同一种物质的是 。
参考答案:(8分)(1)②?(2)④ ?(3)⑥?(4)⑤
本题解析:同位素是指质子数相同,中子数不同的同一种元素的不同核素互称为同位素,所以答案是②;分子式相同结构不同的化合物互为同分异构体,答案选③;结构相似,分子组成相差若干个CH2原子团的同一类有机物的,互称为同系物,答案选⑥;性质和结构都完全相同的是同一种物质,答案是⑤。
本题难度:一般
4、填空题 (14分)下面是18×7的格子,按要求作答。
A
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| He
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| C
| D
| ?
| ?
|
?
| E
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| F
| ?
| ?
| ?
| H
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
(1)用封闭的实线绘出元素周期表的轮廓。注意:不得使用铅笔作图。(3分)
(2)“大爆炸理论”指出:200亿年以前,宇宙中所有物质都包含在一个密度无限大,温度无限高的原始核中,由于某种原因它发生了爆炸,首先产生了中子、质子和电子,随后就产生了元素。你由此可知最先产生的元素是_______(填写元素名称)(1分),其中子数比质子数多1的核素的原子符号是_________;(1分)
(3)C、D、E、F的简单离子半径由小到大顺序是_______________________(填写离子符号);(2分)
(4)请用电子式表示出E和H形成的化合物形成过程:_____________________________;(2分)
(5)用实线绘出金属与非金属的分界线。注意:不得使用铅笔作图。(2分)
(6)用来组成酸、碱、盐三类物质至少需要的元素有__________(填写表中字母)。(3分)
参考答案:
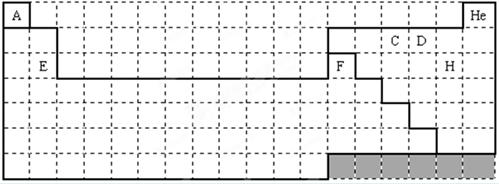
(1)实线轮廓应封闭。注意:不得使用铅笔作图。(3分)
(2)氢(1分),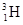 或T;(1分)? (3)Al3+<Mg2+<O2—<N3—;(2分)
或T;(1分)? (3)Al3+<Mg2+<O2—<N3—;(2分)
(4)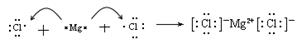 (2分)
(2分)
(5)见图,(2分,共两处,各1分)? (6)A、C、D (3分,各1分)
本题解析:(1)、(5)考查元素周期表的结构,图见答案。
(2)根据中子、质子和电子产生的先后顺序可知,最早产生的元素应该是质子数最小的氢元素。氢元素的质子数是1,所以中子数比质子数多1的核素的原子符号是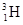 或T。
或T。
(3)C、D、E、F的简单离子都是10电子,核外电子排布相同,对应核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以顺序是Al3+<Mg2+<O2—<N3—。
(4)E是活泼的金属元素镁,H是活泼的非金属元素氯,二者形成的化学键是离子键,其形成过程为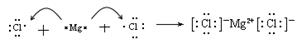 。
。
(6)形成酸的元素一定还原氢元素,形成碱的元素一定有氧元素,所以用来组成酸、碱、盐三类物质至少需要的元素有H、N、O。分别是可以是硝酸、一水合氨和硝酸铵。
本题难度:一般
5、填空题 (14分)巳知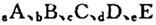 元索,
元索,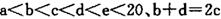 。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。
。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。
(1) B的原子结构示意图为_________;E在元素周期表中的位置________。
(2) 已知C2及其化合物有以下转化关系(部分物质已省略):

①将已收集满气体Y的试管管口倒扣在水面下,可以观察到的现象是________;其化学反应方程式为________; W的晶体类型为________;将E单质与Z的极稀溶液混合,还原产物只有W,则该反应的离子方程式为________________________。
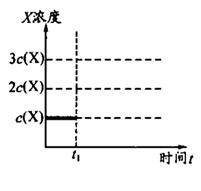
②上述合成X的反应处于平衡状态时,气体X的浓度为C(X)(如图)。在恒温恒容条件下,t1时刻通人X将X的浓度变为2c(X)。请在下图画出平衡移动过程中X浓度的变化趋势图。
(3) 由其中三种元素形成的只含极性键、具有18电子的共价化合物为________ (写结构简式,至少2种)。
参考答案:(1)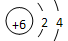 ;第三周期第ⅢA
;第三周期第ⅢA
(2)①红棕色气体逐渐变为无色,气体体积减小到原来的1/3,液面上升(至2/3);3NO2+H2O=NO+2 HNO3;离子晶体;8Al+30H++3NO-=3NH4++8Al3++9H2O
②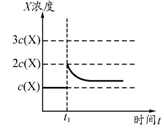
(3)CH3OH、NH2OH、CH3NH2等
本题解析:常温常压下密度最小的气体是氢气,A是H。B的单质有多种同素异形体,其中一种为质软灰黑色固体,常见质软灰黑色固体是石墨,即B是碳元素。C的最外层电子数是电子层数的2. 5倍,则只能是氮元素。因为b+d=2c,所以D是氧元素。E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物,说明E既能与酸反应也能与碱反应,是铝元素。
(1)略
(2)根据转化关系可知X、Y、Z、W分别是NH3、NO2、HNO3、NH4NO3。NO2溶于水生成硝酸和NO,方程式为3NO2+H2O=NO+2 HNO3,所以红棕色气体逐渐变为无色,气体体积减小到原来的1/3,液面上升(至2/3)。根据得失电子守恒可写出反应的方程式:8Al+30H++3NO-=3NH4++8Al3++9H2O。
(3)增大氨气浓度,平衡向逆反应方向移动,但平衡后氨气的浓度将大于c (NH3)而小于2 c (NH3),如图所示: 。
。
(3)只含极性键说明不能有铝元素,又因为具有18电子的共价化合物,所以不能同时含有C、N和O,必须含有H元素,故常见的有CH3OH、NH2OH、CH3NH2等
本题难度:一般