微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列结构示意图所对应的晶体中,化学式为XY2且属于分子晶体的是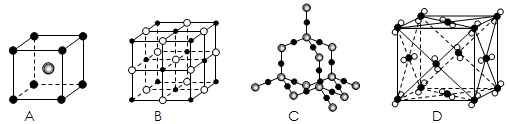
2、填空题 (1)中国古代四大发明之一——黑火药,它的爆炸反应为:


①除S外,上列元素的电负性从大到小依次为?。
②在生成物中,A的晶体类型为?,含极性共价键的分子的中心原子轨道杂化类型为?。
③已知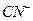 与
与 结构相似,推算HCN分子中
结构相似,推算HCN分子中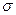 键与
键与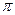 键数目之比为?。
键数目之比为?。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为?, 的未成对电子数是?。
的未成对电子数是?。
(3)在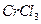 的水溶液中,一定条件下存在组成为
的水溶液中,一定条件下存在组成为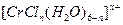 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
交换出来的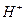 经中和滴定,即可求出x和n,确定配离子的组成。
经中和滴定,即可求出x和n,确定配离子的组成。
将含0.0015 mol 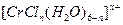 的溶液,与R-H完全交换后,中和生成的
的溶液,与R-H完全交换后,中和生成的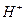 需浓度为0.1200 mol
需浓度为0.1200 mol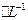 ?NaOH溶液25.00 ml,呆知该配离子的化学式为?。
?NaOH溶液25.00 ml,呆知该配离子的化学式为?。
3、填空题 石墨晶体中C-C键的键角为?,其中平均每个六边形所含的C原子数为?个。
4、计算题 现有A、B、C三种物质,A为气态氢化物,分子式为RH3,含R为82.4%,B是另一种气态氢化物,A+B→C,C与碱液共热放出A。C的水溶液加入稀HNO3酸化后,滴入AgNO3溶液,产生不溶性的白色沉淀,完成下列问题:?
(1)写出A的名称和电子式,并指出它是否是极性分子?其稳定性比PH3、H2O强还是弱??
(2)写出B的名称和电子式,并指出它是否是极性分子?其稳定性比HF、H2S、HBr如何?其水溶液的酸性比HF、HBr、H2S如何??
(3)写出C的名称和电子式,具体指明C物质中各部分的化学键,指出C形成的晶体类型。?
(4)写出上述有关的化学方程式或离子方程式。?
5、填空题 (选做题)(19分)图表法、模型法是常用的科学研究方法。
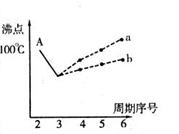
I.下图是研究部分元素的氢化物的沸点变化规律的图像。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b(其中A点对应的沸点是100℃),你认为正确的是?,理由是?。
II.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
(1)22Ti元素基态原子的价电子层排布式为?。
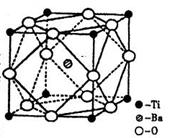
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,价电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,则它的化学式是?。
III.上世纪60年化,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对情性”的观念。在随后的几年内,科学家又相继后成了氙的氟化物、氧化物等。
(1)金属Pt内部原子的堆积方式与铜及干冰中的CO2相同,右图正方体是Pt晶胞的示意图,试说出Pt原子在晶胞中的位置?。

(2)稀有气体(氡除外)中,只有较重的氙能合成出多种化合物,
其可能原因是?(填字母代号)
A.氙的含量比较丰富
B.氙的相对原子质量大
C.氙原子半径大,电离能小
D.氙原子半径小,电负性大