微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于反应2SO2+O2 2SO3,下列判断正确的是
2SO3,下列判断正确的是
[? ]
A.2体积SO2和足量O2反应,必定生成2体积SO3
B.其他条件不变,增大压强,平衡必定向右移动
C.平衡时,SO2消耗速度必定等于O2的生成速率
D.平衡时,SO2浓度必定等于O2浓度的两倍
参考答案:B
本题解析:
本题难度:一般
2、选择题 化学平衡常数(K)、弱酸的电离常数(Ka)、难溶物的溶度积常数(KSP)是判断物质性质或变化的重要的平衡常数.下列关于这些常数的说法中,正确的是(? )
A.平衡常数的大小与温度、浓度、压强、催化剂等有关
B.当温度升高时,弱酸的电离常数Ka变小
C.KSP(AgCl)>KSP(AgI),由此可以判断AgCl(s)+I-=AgI(s)+Cl-能够发生
D.Ka(HCN)<Ka(CH3COOH),说明相同物质的量浓度时,氢氰酸的酸性比醋酸强
参考答案:C
本题解析:
本题难度:简单
3、填空题 (本题共12分)大约100年前,德国化学家哈伯(F.Haber)开始研究由氮气和氢气合成氨。一种工业合成氨的简易流程图如下:
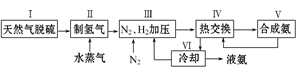
28.天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________________________。
29.工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化含某些杂质的原料氢气。已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27。R原子核外电子有_____种不同运动状态,最外层的p电子有_______种自旋方向。
30.常温下,不能与M单质发生反应的是_________(填序号)
A.CuSO4溶液
B.Fe2O3
C.浓硫酸
D.NaOH溶液
E.Na2CO3固体
步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g) CO(g)+3H2(g)- 206.4 kJ
CO(g)+3H2(g)- 206.4 kJ
②CO(g)+H2O(g) CO2(g)+H2(g)+ 41.2 kJ
CO2(g)+H2(g)+ 41.2 kJ
31.对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是 。
A.升高温度 B.增大水蒸气浓度 C.加入催化剂 D.降低压强
32.利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为__________。
33.依据温度对合成氨反应的影响,在下图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

参考答案:28.2NH4HS+O2=2NH3·H2O+2S↓ 29. 14, 1 ;30. B 、E;31.A;32. 90%;
33. 。
。
本题解析:28.在一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,则再生反应的化学方程式是2NH4HS+O2→2NH3·H2O+2S↓;
29.工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化含某些杂质的原料氢气。已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27。由于M的化合价是+3价,则R是Al,Al是13号元素,则R是14号元素。R原子核外电子有14种不同运动状态,最外层的p电子有2个,它们的自旋方向相同,故有1种自旋方向;
30.A.CuSO4溶液与Al发生置换反应产生Cu,错误;B.Fe2O3与Al不能发生反应,正确;C.浓硫酸与Al在加热时发生氧化还原反应 ,错误;D.NaOH溶液与Al发生氧化还原反应产生NaAlO2和H2,错误;E. Na2CO3固体与Al不能发生反应,正确。故选项是B、E;
31.对于反应①,由于该反应的正反应是气体体积增大的吸热反应, A.升高温度,化学反应速率加快,由于该反应是正反应是吸热反应,升高温度,平衡正向移动,平衡体系中H2百分含量增大,正确; B.增大水蒸气浓度,反应速率加快,平衡正向移动,但是平衡移动的趋势是微弱的,所以平衡体系中H2百分含量降低,错误; C.加入催化剂,化学反应速率加快,但是由于催化剂对正反应、逆反应的速率影响相同,所以平衡不发生移动,错误; D.降低压强,反应速率减慢,根据平衡移动原理:减小压强,平衡向气体体积增大的正反应方向移动,平衡体系中H2百分含量增大,错误。选项是A。
32.反应②是气体体积不变的放热反应, 为将CO进一步转化,可提高H2产量。应该将平衡正向移动。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应, 根据方程式CO(g)+H2O(g) CO2(g)+H2(g)可知:若有1mol的CO完全反应,产生CO2和H2,会增加1mol的气体,现在气体增大的物质的量是0.18mol,所以反应消耗的CO的物质的量是0.18mol,而在1 mol CO和H2的混合气体(CO的体积分数为20%)中含有CO的物质的量是0.2mol,所以CO转化率为(0.18mol÷0.2mol)×100%=90%。
CO2(g)+H2(g)可知:若有1mol的CO完全反应,产生CO2和H2,会增加1mol的气体,现在气体增大的物质的量是0.18mol,所以反应消耗的CO的物质的量是0.18mol,而在1 mol CO和H2的混合气体(CO的体积分数为20%)中含有CO的物质的量是0.2mol,所以CO转化率为(0.18mol÷0.2mol)×100%=90%。
33.合成氨反应的反应是放热反应,根据温度对反应的影响,可知在一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图是

考点:考查化学方程式的书写、元素的推断、原子核外电子的运动状态、物质的化学性质的判断、外界条件对化学反应速率和平衡移动的影响、物质的平衡转化率的计算、温度对物质的合成及平衡移动的影响的图像法表示的知识。
本题难度:困难
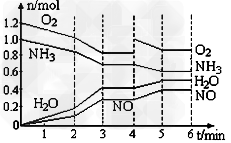
4、选择题 一密闭容器中,400℃时存在一个化学平衡。反应进行至2?min、4?min时,分别只改变了某一条件,容器中四种物质的物质的量n?(mol)随时间t?(min)变化如图,下列说法不正确的
[? ]
A.平衡涉及反应为4NH3+5O2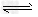 4NO+6H2O?
4NO+6H2O?
B.0至3分钟气体的平均分子量在逐步减小
C.第4至5分钟平衡在右移,NH3的转化率提高
D.2?min、4?min时改变条件可能为降温、加入O2
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列反应中符合下图图像的是? ( )。

A.N2(g)+3H2(g) 2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0)
2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0)
B.2SO3(g) 2SO2(g)+O2(g)ΔH=+Q2 kJ·mol-1(Q2>0)
2SO2(g)+O2(g)ΔH=+Q2 kJ·mol-1(Q2>0)
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH=-Q3 kJ·mol-1(Q3>0)
4NO(g)+6H2O(g)ΔH=-Q3 kJ·mol-1(Q3>0)
D.H2(g)+CO(g) C(s)+H2O(g)ΔH=+Q4 kJ·mol-1(Q4>0)
C(s)+H2O(g)ΔH=+Q4 kJ·mol-1(Q4>0)
参考答案:B
本题解析:根据图示可得升高温度平衡向着生成物方向(吸热方向)移动,增加压强平衡向逆反应方向(气体总量减少的方向)移动,对照选项,只有选项B符合。
本题难度:一般