微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)请写出以下物质的电子式:
Cl2? CO2? Na2S?
参考答案:(6分) (每空2分) 略
本题解析:略
本题难度:一般
2、选择题 下列叙述正确的是( )
A.分子中一定含有化学键
B.共价化合物一定不含离子键
C.含有金属元素的离子一定是阳离子
D.非金属元素的化合物一定不含离子键
参考答案:B
本题解析:A错,如稀有气体分子不存在化学键;B正确,共价化合物一定不含离子键,若有离子键则一定为离子化合物;C错,含有金属元素的离子不一定是阳离子,如ALO2—;D错,如铵盐,均由非金属元素组成;
本题难度:简单
3、选择题 在离子 RO3n-中,  共有 x 个核外电子,R原子的质量数为A,氧原子的质子数为8, 则 R 原子核内含有的质子数目是
共有 x 个核外电子,R原子的质量数为A,氧原子的质子数为8, 则 R 原子核内含有的质子数目是
A.A–x+n+48
B.A–x+n+24
C.x-n–24
D.X+n–24
参考答案:C
本题解析:略
本题难度:简单
4、填空题 (本题共8分)在玻璃生产中,熔炉里原料发生的主要反应为:
2Na2CO3+CaCO3+3SiO2 2Na2SiO3+CaSiO3+3CO2↑
2Na2SiO3+CaSiO3+3CO2↑
(1).某反应物在熔融状态下不导电,它属于_____晶体。
(2).上述反应里,在周期表中相邻两元素的原子半径______>______(填元素符号) ,处于同一周期元素的名称是__________________。
(3).上述反应里金属性最强的短周期元素,其原子核外有______种不同能级的电子,其单质在O2中充分燃烧,产物的电子式为_____________。
(4).H2与O2发生反应的过程用模型图示如下(“—”表示化学键):
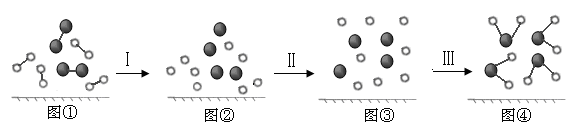
其中过程Ⅰ是______过程(填“吸热”、“放热”或“没有能量变化”)。图④中产生了由极性键构成的__________分子(填“极性”或“非极性”)。
参考答案:(1).原子?(1分)
(2).Si? C? (1分)?碳与氧?钠与硅? (共2分,各1分)?
(3).4?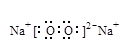 ?(共2分,各1分)
?(共2分,各1分)
(4).吸热 (1分)?极性? (1分)
本题解析:(1).二氧化硅在熔融状态下不导电,是原子晶体。
(2).碳和硅属于同一主族的相邻元素,同主族自上而下原子半径逐渐增大,所以硅原子半径大于碳原子半径。属于同一周期的是碳互为氧以及钠和硅。
(3)金属性最强的是钠,根据构造原理可知,有4种不同能级的电子。钠在氧化中的燃烧产物是过氧化钠,含有离子键和非极性键的离子化合物。
(4).过程I是断键过程,吸热。水是由极性键构成的极性分子。
本题难度:一般
5、选择题 短周期元素甲、乙、丙、丁在元素周期表的相对位置如下表所示,其中甲的气态氢化物的水溶液呈碱性,则下列判断正确的是
?
A.甲位于元素周期表中第2周期、第ⅤA族
B.原子半径:甲>乙
C.单质的氧化性:丙>乙
D.气态氢化物稳定性:丁>丙>乙
参考答案:AB
本题解析:根据“甲的气态氢化物的水溶液呈碱性”确定甲为氮元素,再结合这些元素的相对位置关系确定乙?为氧元素、丙为硫元素、丁为氯元素。C项单质的氧化性是乙>丙,错误;D项气态氢化物的稳定性是乙>丁>丙,错误。
本题难度:简单