微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),R、X、Y三种元素的原子核外电子层数相同,同一周期中R的一种单质的熔点最高,Y与Q、R、X、Z均能形成多种常见化合物。
(1)X在周期表中的位置:?,其原子核外有?种不同形状的电子云。这五种元素中,最外层有两个未成对电子的元素是?(用元素符号表示)。
(2)常温下液态化合物甲只含上述元素中的两种,分子中原子个数比1︰1,甲的电子式是_______________。
(3)Q分别与X、Y形成的最简单化合物的稳定性______>______(用分子式表示)
(4)Q与R两元素可组成多种分子,其空间构型可能是?(填写序号)。
a.直线型? b.平面形? c.三角锥形? d.正四面体
(5)X的氧化物是形成光化学烟雾原因之一,工业上可采用它与其氢化物反应生成无毒害物质而除去,请用方程式表示该反应?。
参考答案:(1)第2周期第VA族? 2? C? O (2)H2O2的电子式 (3)H2O>NH3(4)abd
(3)H2O>NH3(4)abd
(5)6NO2+8NH3=7N2+12H2O或6NO+4NH3=5N2+6H或6NOX+4XNH3=(3+2X)N2+6XH2O
本题解析:(1)根据题意可推知:个元素分别是Q:H;R:C;X:N;Y:O;Z:Cl.其中N元素在周期表中的位置是第二周期第Ⅴ主族。它的原子核外有S、P两种不同形状的电子云。这五种元素中,最外层有两个未成对电子的元素是C。(2)常温下液态化合物甲只含上述元素中的两种,分子中原子个数比1︰1的化合物是H2O2,其电子式是 。(3)元素的非金属性O>C。元素的非金属性越强,其对于的氢化物越稳定。故Q分别与X、Y形成的最简单化合物的稳定性H2O>NH3。(4)C2H2是直线型;C2H4、C6H6平面形;CH4正四面体。所以选项为:abd。(5)NO、NO2是形成光化学烟雾原因之一,工业上采用它与其氢化物反应生成无毒害物质而除去方程式是:6NO2+8NH3=7N2+12H2O或6NO+4NH3=5N2+6H或6NOX+4XNH3=(3+2X)N2+6XH2O。
。(3)元素的非金属性O>C。元素的非金属性越强,其对于的氢化物越稳定。故Q分别与X、Y形成的最简单化合物的稳定性H2O>NH3。(4)C2H2是直线型;C2H4、C6H6平面形;CH4正四面体。所以选项为:abd。(5)NO、NO2是形成光化学烟雾原因之一,工业上采用它与其氢化物反应生成无毒害物质而除去方程式是:6NO2+8NH3=7N2+12H2O或6NO+4NH3=5N2+6H或6NOX+4XNH3=(3+2X)N2+6XH2O。
本题难度:一般
2、填空题 【化学——选修3:物质结构与性质】(15分)
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为____________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________。
?
| 氟
| 氯
| 溴
| 碘
|
第一电离能
(kJ/mol)
| 1681
| 1251
| 1140
| 1008
|
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:

请比较二者酸性强弱:HIO3_____ H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2-?为角型,中心氯原子周围有四对价层电子。ClO2-?中心氯原子的杂化轨道类型为___________,写出一个ClO2-?的等电子体__________。
(6)下图为碘晶体晶胞结构。有关说法中正确的是_____________。

A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。

参考答案:(1)P (1分)4S24P5(1分)?(2) 氢键(1分)
(3)碘(2分)?(4)>(2分)
(5)sp3 (2分) Cl2O (或OF2等合理答案) (2分)
(6)AD(2分)
(7)a3ρNA/4(2分)
本题解析:⑴卤族元素位于周期表第17列(P区),溴(主族元素)原子的价电子排布为4S24P5;
⑵氢氟酸分子间通过氢键缔合成(HF)2。
⑶由于碘的第一电离能在卤素原子中相对较小,最有可能生成较稳定的单核阳离子。
⑷HIO3的非羟基氧原子数(2)多,酸性较H5IO6 [非羟基氧原子数为1]强。
⑸由于ClO2-?的中心氯原子周围有四对价层电子,其中心氯原子的杂化轨道类型为sp3;根据“增减找邻、同族互换”的原则可确定ClO2-?的等电子体为Cl2O或OF2。
⑹碘晶体晶胞结构属于面心立方晶胞,每个晶胞中含有8×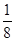 +6×
+6×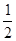 =4个碘分子,但碘原子数为8,B项错误;碘晶体属于分子晶体,C项错误。
=4个碘分子,但碘原子数为8,B项错误;碘晶体属于分子晶体,C项错误。
⑺在CaF2晶胞中含有Ca2+:8×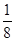 +6×
+6×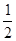 =4个,含有F-:8个,相当于有4个CaF2,则ρ=
=4个,含有F-:8个,相当于有4个CaF2,则ρ= ,化简得M=)a3ρNA/4。
,化简得M=)a3ρNA/4。
本题难度:一般
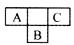
3、选择题 A、B、C都是短周期元素,在周期表中所处的位置如图所示。A、B、C三种元素的原子质子数之和为32,D元素原子的最外层电子数为其次外层电子数的2倍。则下列说法正确的是?

A.元素D形成的气态氢化物一定是正四面体形分子
B.A、B两种元素的气态氢化物均能与它们对应的最高价氧化物对应的水化物发生反应,且反应类型相同?
C.B、C两种元素可形成BC6型化合物,该化合物在空气中不能燃烧
D.已知BC6的结构呈正八面体构型,若C有两种稳定的同位素,则BC6的不同分子种数有10种
参考答案:CD
本题解析:A、B、C、D四种元素依次为:氮、硫、氟、碳。碳元素因存在多种气态烃,不一定是正四面体形分子;NH3与HNO3、H2S与浓H2SO4分别反应时,前者是非氧化还原反应,后者是氧化还原反应,故A、B两项均错误;SF6中S显+6价,不能再被氧化,-1价F的还原性很弱,不能被O2氧化,故C选项正确;正八面体中,顶点间的距离只有两种:菱形中的相邻位置及对角线位置,故D项也正确。
本题难度:一般
4、填空题 (12分)下表为长式周期表的一部分,其中的编号代表对应的元素。试填空。
①
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ②
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ③
| ④
| ⑤
| ⑥
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ⑦
| ?
| ?
| ?
| ⑧
| ?
|
?
| ?
| ?
| ?
| ?
| ⑨
| ?
| ?
| ⑩
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
(1)写出上表中元素⑨原子的外围电子排布式?。
(2)元素③与⑧形成的化合物中元素③的杂化方式为:?杂化,其形成的化合物的晶体类型是:______________?_?_。
(3)元素④、⑤的第一电离能大小顺序是:?>?(用元素符号表示);元素④与元素①形成的X分子的空间构型为:?。请写出与N3—互为等电子体的分子或离子的化学式?,?(各写一种)。
(4)在测定①与⑥形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是:?。
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质,写出元素②的氢氧化物与NaOH溶液反应的化学方程式?。
(6)元素⑩在一定条件下形成的晶体的基本结构单元如下图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为:?。
参考答案:(1)3d54s1?;?(2)sp3?;分子晶体
(3)N>O;三角锥形, CO2,或CS2、N2O、BeCl2) CNO-
(4)HF分子之间有氢键,形成(HF)n
(5)Na2BeO2
(6)2∶3,(或8∶12、4∶6)
本题解析:略
本题难度:一般
5、选择题 已知Br2在有机溶剂中的溶解度比在水中的大,下列有机溶剂不能从溴水中萃取溴的是
A.酒精
B.苯
C.四氯化碳
D.汽油
参考答案:A
本题解析:萃取时,两种溶剂必须互不溶解,否则混合物不分层,无法分液.乙醇与水以任意比互溶,不能从溴水中萃取出Br2.四氯化碳、汽油和苯都不溶于水,可以从溴水中萃取出Br2,但也有不同,溴的四氯化碳溶液沉在下面,而溴的汽油溶液和溴的苯溶液均浮在上面.
本题难度:一般
[-pa 91Exam.orgge-]
1、填空题 (8分)已知X、Y、Z、W四种元素分别是元素周期表中三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z二种元素的元素符号:X_________、Z__________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的结构式为:?,它的共价键属于?(填:极性、非极性)键;含有离子键和非极性共价键的化合物的电子式为?。
(3)由X、Y、Z所形成的常见离子化合物是___________,该化合物与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式为:___________________;
X与W形成的化合物与水反应时,水是?(填:氧化剂、还原剂)。
2、选择题 已知短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是?
A.质子数c>b
B.离子还原性Y2->Z-
C.氢化物稳定性H2Y>HZ
D.原子半径X<W
3、填空题 (13分)A、B、C、D、E为短周期元素,其原子序数依次增大。其中,A元素原子半径最小;B元素原子的电子总数与最外层电子数之比为3 :2;C元素最高价氧化物对应水化物与其氢化物反应生成一种盐甲。A、E同主族,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。请回答:
(1)写出B元素在周期表中的位置?,C单质的电子式是____________。
(2)A、D、E组成的化合物乙与氯化亚铁溶液反应的实验现象为?。
(3)常温下,甲的水溶液pH_______7(填>、<或=),其原因是(用离子方程式表示)_____________________。
(4)乙和B、D、E组成的化合物丙,它们的水溶液pH均为12时,两溶液中由水电离出的c(OH-),乙:丙=?。
(5)A和B组成化合物丁,其相对分子质量为16。将右图装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状液滴生成等现象。油状液滴的成分可能是(写分子式)?。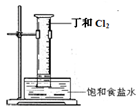
4、填空题 (6分). A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,且A、B、D、E同周期,A、C同主族,A的原子结构示意图如图, B的最外层电子数比K层电子多1,D元素的主族序数是周期序数的2倍,E的单质是黄绿色气体;据此填空:
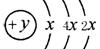
(1) 指出元素A在周期表中的位置?。
(2) D和E两种元素相比较,非金属性较强的是(填元素符号)?,
可以验证该结论的是(填写字母序号)?;
A.比较这两种元素的常见单质的熔沸点? B.比较这两种元素的气态氢化物的熔沸点
C.比较这两种元素的气态氢化物的稳定性? D. 比较这两种元素置换能力的强弱
(3)C、D、E三种元素最高价氧化物的水化物的酸性由强到弱的顺序:
?。(填写化学式)
5、选择题 某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为 ( )
A.H2XO3
B.HXO3
C.H3XO4
D.H2XO4