微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 铜在自然界存在于多种矿石中,如:
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石
主要成分
CuFeS2
Cu5FeS4
Cu2S
CuCO3?Cu(OH)2
|
①上表所列铜化合物中,铜的质量百分含量最高的是______.
②工业上以黄铜矿为原料.采用火法溶炼工艺生产铜.该工艺的中间过程会发生反应:2Cu2O+Cu2S6Cu+SO2↑,反应的氧化剂是______.
③SO2尾气直接排放到大气中造成环境污染的后果是______;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称______.
④黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制.请简述粗铜电解得到精铜的原理:______.
⑤下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是______(填字母).
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断
A
铜绿的主成分是碱酸铜
可用稀盐酸除铜器表面的铜绿
Ⅰ对;Ⅱ对;有
B
铜表易形成致密的氧化膜
铜容器可以盛放浓硫酸
Ⅰ对;Ⅱ对;有
C
铁比铜活泼
例在铜板上的铁钉在潮湿空气中不易生锈
Ⅰ对;Ⅱ对;有
D
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化
硫酸铜溶液可用作游泳池的消毒剂
Ⅰ错;Ⅱ对;无
参考答案:(1)铜化合物中,铜的质量百分含量=铜的原子量×原子个数分子量×100%,
黄铜矿中铜的含量=6464+56+32×2×100%=35%;
斑铜矿中铜的含量=64×564×5+56+32×4×100%=63%;
辉铜矿中铜的含量=64×264×2+32×100%=80%;
孔雀石中铜的含量=64×264×2+12+16×5+1×2×100%=58%
所以铜的质量百分含量最高的是Cu2S.
故答案为:Cu2S.
(2)2Cu2O+Cu2S?高温?.?6Cu+SO2↑,该反应中铜的化合价由+1价变为0价,铜元素在该反应中得电子化合价降低,所以该反应中的氧化剂是Cu2O,Cu2S.
故答案为:Cu2O,Cu2S.
(3)二氧化硫是有毒气体,二氧化硫溶于水后形成酸性溶液,随雨水降下,就可能形成酸雨;二氧化硫能溶于水,且能和水反应生成亚硫酸,亚硫酸能被氧化成硫酸,二氧化硫是酸性氧化物,所以能用碱液吸收生成盐,如硫酸铵.
故答案为:二氧化硫是有毒气体,二氧化硫溶于水后形成酸性溶液,随雨水降下,就可能形成酸雨;硫酸,硫酸铵.
(4)粗铜电解得到精铜的原理:电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液.阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu 2+进入溶液中Cu-e-═Cu 2+;阴极上发生还原反应,Cu 2+得到电子在阴极上析出Cu单质,Cu 2++e-═Cu,从而达到精制Cu的目的.
故答案为:粗铜电解得到精铜的原理:电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液.阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu 2+进入溶液中Cu-e-═Cu 2+;阴极上发生还原反应,Cu 2+得到电子在阴极上析出Cu单质,Cu 2++e-═Cu,从而达到精制Cu的目的.
(5)A、Ⅰ铜绿的主成分是碱式碳酸铜,故正确;Ⅱ碱式碳酸铜能和强酸反应生成盐和水、二氧化碳,故正确;碱式碳酸铜是弱酸盐能和强酸反应,所以二者有因果关系,故A正确.
B、Ⅰ铜是不活泼金属,所以其表面不易形成致密的氧化膜,故错误;Ⅱ常温下,铜和浓硫酸不反应,所以铜容器可以盛放浓硫酸,故正确;二者没有、因果关系,所以B错误.
C、Ⅰ铁的金属性比铜的金属性强,所以铁比铜活泼,故正确;Ⅱ在铜板上的铁钉在潮湿空气中易形成原电池,所以易生锈,故错误;二者有因果关系,所以C错误.
D、Ⅰ蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是化学变化,故错误;硫酸铜是重金属盐,能使蛋白质变性,所以溶液可用作游泳池的消毒剂,故正确;二者没有因果关系,所以D正确.
故选AD.
本题解析:
本题难度:简单
2、选择题 在冶金工业上,均不能用通常化学还原剂制得的金属组是( )
A.Na、Mg、Al
B.Na、K、Zn
C.Fe、Cu、Ag
D.Na、Ca、Cu
参考答案:A
本题解析:
本题难度:简单
3、选择题 如图所示,按A图装置进行实验,若图B的x轴表示流入电极的电子的量,则y轴不可能表示的是

[? ]
A.Ag+浓度
B.NO3-浓度
C.铁棒质量
D.银棒质量
参考答案:CD
本题解析:
本题难度:一般
4、实验题 实验室日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:?
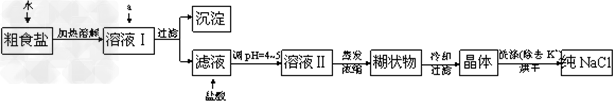
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液?NaOH溶液?BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳
①欲除去溶液中的Ca2+、Mg2+、Fe3+、SO42-离子,用所给的试剂,按滴加顺序依次为
_________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为______________。
(2)用提纯的NaCl配制500?mL?4.00?mol·L-1NaCl溶液,所用仪器出药匙、玻璃棒外还有
_________。
a、天平?b、烧杯?c?、锥形瓶?d?、500?mL容量瓶?e、250?mL容量瓶? f、胶头滴管?g、移液管
(3)电解饱和食盐水的装置如图所示,若收集的H2为2?L,则同样条件下收集Cl2小于2?L,原因是_______________。此副反应的产物之一是84消毒液的主要成分,其消毒的原理是______________________。?

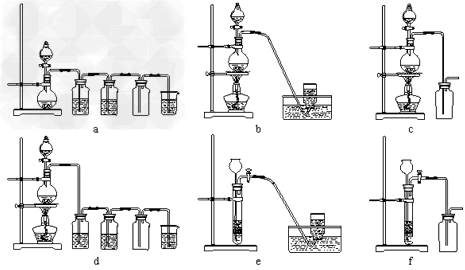
(4)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4==ZnSO4+H2↑ MnO2+4HCl(浓)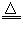 MnCl2+Cl2↑+2H2O据此,制备并收集干燥、纯净Cl2的装置是__________(填代号)。 MnCl2+Cl2↑+2H2O据此,制备并收集干燥、纯净Cl2的装置是__________(填代号)。
参考答案:(1 )① BaCl2、NaOH 、Na2CO3;② 75%乙醇
(2 )a b d?f
(3 )电解生成的氯气与NaOH 发生了反应;次氯酸钠消毒杀菌最主要的作用方式是通过它的水解形成次氯酸
(4 )d
本题解析:
本题难度:一般
5、选择题 从海水中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁.下列说法不正确的是( )
A.此法的优点之一是原料来源丰富
B.第④步电解时阴极产生氯气
C.①②③步骤的目的是从海水中提取MgCl2
D.以上提取镁的过程中涉及化合、分解和复分解反应
参考答案:B
本题解析:
本题难度:一般
|