微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
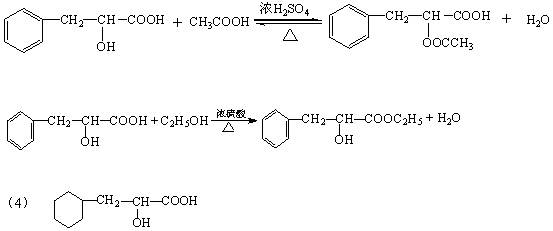
1、填空题 (本题12分)有机物A是一种重要化工生产的中间体,其结构简式为:C6H5-CH2CH(OH)COOH
(1)A中含有的官能团有:?、?(填名称)。
(2)A可能具有的化学性质有:?(填序号)
①能与H2发生加成反应;②能与在烧碱溶液中发生水解反应;③能与甲酸发生酯化反应;④能金属钠发生反应,且有机物A与反应生成的氢气物质的量之比为1∶1反应;⑤能与Ag(NH3) 2OH溶液发生银镜反应。
(3)写出A分别与乙醇、乙酸发生酯化反应的方程式:
?
?。
(4)在催化剂Pt的作用下,A与H2加成后的生成物的结构简式为?。
参考答案:(16分)(1)羟基?羧基?(4分)
(2)①③④?(其余每空3分)
(3)
本题解析:略
本题难度:简单
2、选择题 某一元饱和羧酸跟CH3CH2CH2OH反应,消耗该一元醇15 g,得到25.5 g酯,则该一元饱和羧酸的结构简式是(?)
A.HCOOH
B.CH3COOH
C.C2H5COOH
D.C3H7COOH
参考答案:B
本题解析:15 g醇的物质的量为 ,设羧酸的摩尔质量为x g·mol-1。则有:15+0.25x-18×0.25=25.5,x=60,所以选C项。
,设羧酸的摩尔质量为x g·mol-1。则有:15+0.25x-18×0.25=25.5,x=60,所以选C项。
本题难度:简单
3、填空题 利用工业生产硫酸的废渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)制备铁红的流程如下图所示
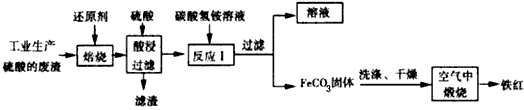
(1)酸浸、过滤后滤液中的主要成分是____________。
(2)FeCO3浑浊液长期暴露在空气中,会有部分固体表面变为红褐色,该变化的化学反应方程式为________________________。
(3)在空气中煅烧FeCO3生成铁红的化学反应方程式为_____________________。
(4)FeCO3固体吸附一些硫酸根离子,如何洗涤FeCO3固体以及如何判断是否洗涤干净?洗涤的方法是
_____________;判断是否洗涤干净的方法是____________________。
参考答案:
(1)FeSO4(或H2SO4和FeSO4)
(2)4FeCO3+6H2O+O2=4Fe(OH)3+4CO2
(3)4FeCO3+O2 2Fe2O3+4CO2
2Fe2O3+4CO2
(4)向过滤器中加入蒸馏水浸没沉淀,过滤,重复几次;用试管取少量洗涤液,滴加氯化钡,有白色沉淀生成则没有洗净,没有沉淀生成则表明已洗净
本题解析:
本题难度:一般
4、简答题 A、B、C、D、E、F六种元素,原子序数依次递增,其中A、B、C、D、E均为短周期元素.A元素原子核内无中子;B元素原子最外层电子数是次外层电子数的2倍;D是地壳中含量最高的元素;E和D同主族;F位于周期表的第四周期ⅠA族.根据以上信息用相关的元素符号回答下列问题:
(1)写出C、E的化学式:______;______.
(2)B与D形成化合物BD2的分子式为______,空间构型为______.
(3)A2D的沸点比A2E高的原因是______.
(4)常温常压时,2.8g?BD气体在3.2g?D2气体中完全燃烧,生成BD2气体时放出28、3kJ的热量,则表示BD燃烧热的热化学方程式是______.
(5)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式______.
参考答案:(1)A元素原子核内无中子,应为H元素,B元素原子最外层电子数是次外层电子数的2倍,应为C元素,D是地壳中含量最高的元素,应为O元素,A、B、C、D、E、F六种元素,原子序数依次递增,则C为N元素,E和D同主族,根据原子序数依次增大,应为S元素,故答案为:N;?S;?
(2)B与D形成化合物BD2为CO2,C原子的价层电子对为2,含有2个δ键,为直线形分子,
故答案为:CO2;直线型;
(3)O元素原子半径小,非金属性较强,可形成氢键,所以H2O分子间存在氢键,导致熔沸点升高,
故答案为:H2O分子间存在氢键,导致熔沸点升高;
(4)2.8g?BD气体在3.2g?D2气体中完全燃烧,生成BD2气体时放出28.3kJ的热量,即2.8g?CO气体在3.2g?O2气体中完全燃烧,生成CO2气体时放出28、3kJ的热量,则n(CO)=2.8g28/mol=0.1mol,所以可得CO燃烧热的热化学方程式为CO(g)+12O2(g)=CO2(g)△H=-283KJ/mol,
故答案为:CO(g)+12O2(g)=CO2(g)△H=-283KJ/mol
(5)该反应为C和浓硫酸的反应,反应条件为加热,生成CO2和SO2,反应方程式为C+2H2SO4(浓)?△?.?CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)?△?.?CO2↑+2SO2↑+2H2O.
本题解析:
本题难度:一般
5、填空题 下图为某套实验装置示意图,无法看到实验说明,加热装置已经省略.
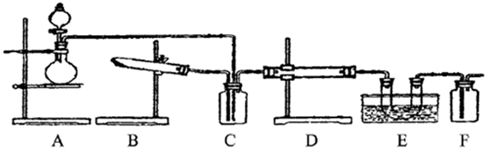
I.甲同学认为当D处盛放V2O5作催化剂时,此套装置可用于合成物质X,并预测E处冰水冷却的U型管中将有固体X出现.
(1)事实上此装置所附实验说明符合甲同学的推断,那么A中所发生的反应的化学方程式是______,C装置中盛放的液体药品的名称是______.
(2)甲同学方案中为了提高A装置产物的转化率,可以增大B装置产物的通入量,欲知A、B两装置中产物在D中的通入量,可通过观察______得知.
(3)本实验在设计上有无缺失之处?若有请答出改进方案______;(若无,此问可不答)
II.乙同学认为若D处盛放铂铑合金网作催化剂,则此套装置也可用于合成物质Y,并预测E处冰水冷却的U型管中将有红棕色气体生成,且越接近U型管底部颜色越浅.
(4)写出乙同学认为的D装置中发生反应的化学方程式______.
(5)对于A处,乙认为没有加热装置,请代乙阐述A中气体的产生原理______(6)若要用上述装置完成乙同学所认为的实验,且C处所起作用与合成X时所起作用基?本一致,那么C处的广口瓶应改为______,所装药品为______.
参考答案:(1)V2O5作催化剂时,是二氧化硫转化为三氧化硫时的反应条件,所以A是制取二氧化硫的装置,所发生的反应的化学方程式是:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;干燥二氧化硫用浓硫酸,
故答案为::Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;浓硫酸;
(2)C装置的作用:干燥二氧化硫;调节二氧化硫和氧气的混合比例;可控制二氧化硫和氧气的产生速率,欲知二氧化硫和氧气在D中的通入量,可通过观察C中两导管口气泡的产生速率来判断,故答案为:C中两导管口气泡的产生速率;
(3)F装置进行尾气处理时,易导致倒吸现象的产生,所以应在EF之间连接一个防倒吸装置,故答案为:有,应在EF之间连接一个防倒吸装置;
(4)铂铑合金网作催化剂,是氨气的催化氧化时的反应条件,所以D装置是氨气的催化氧化反应,其发生反应的化学方程式为:4NH3+5O2?催化剂?.?4NO+6H2O,故答案为:4NH3+5O2?催化剂?.?4NO+6H2O(若多写2NO+O2=2NO2也可以);
(5)可以用浓氨水和固体NaOH(或生石灰或碱石灰)混合不加热的方法来制氨气,其原理是:化学平衡NH3+H2O?NH3?H2O?NH4++OH-的移动原理,故答案为:将分液漏斗中的浓氨水滴加至圆底烧瓶中的固体NaOH(或生石灰或碱石灰)中,反应放热溶液中c(OH-)增大氨水浓度增大,上述三个因素均导致氨水中的平衡:NH3+H2O?NH3?H2O?NH4++OH-向左移动致使NH3逸出;
(6)氨气是碱性气体,需用碱石灰干燥氨气,固体干燥剂放在干燥管中,故答案为:U形管或干燥管,碱石灰(其他合理答案亦可).
本题解析:
本题难度:一般