微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 以黄铁矿为原料生产硫酸的工艺流程图如下
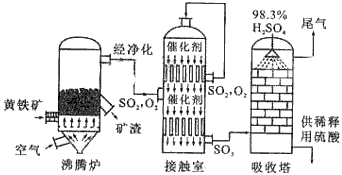
(1)将燃烧黄铁矿的化学方程式补充完整4_______+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是_________________________。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)_______________。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高的SO2反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)每160gSO3气体与H2O化合放出260.6kJ的热量,该反应的热化学方程是__________________________。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的和铵盐。
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是__________________________。
② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果:铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是________%; 若铵盐质量为15.00g。
浓硫酸增加的质量为__________。 (计算结果保留两位小数)
2、填空题 工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
(1)氨催化氧化的化学方程式为_________________:
(2)原料气中空气必须过量,其主要原因是_________________;
(3)将铂铑合金做成薄丝网的主要原因是________________;
(4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为_________________________,为了提高水对二氧化氮的吸收率,可采取的措施为_____________________________(答2项)。
3、选择题 在硫酸的工业制法中,下列生产操作与说明的原因二者都正确的是( )
A.硫铁矿燃烧前需将矿粒粉碎,这样易于向沸腾炉中投料
B.炉气进入接触室之前需要净化、干燥,因为炉气中的杂质易与SO2反应
C.SO2氧化为SO3时需使用催化剂,这样可提高SO2的转化率
D.接触室的反应温度控制在400~500℃,因为在该温度范围内催化剂的活性较高
4、选择题 阿斯匹林的结构简式为:
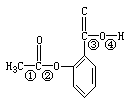
把阿斯匹林放在足量的NaOH溶液中煮沸,能发生反应的化学键是
A.①④
B.①③
C.②③
D.②④
5、填空题 (三选一)【选修2:化学与技术】
以磷肥厂排出的废渣磷石膏为原料制硫酸,同时生产水泥,制得的硫酸又用于生产磷肥。硫酸、磷肥、水泥联合生产示意图如下
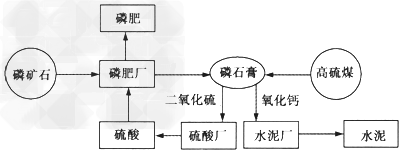
(1)利用磷矿石[Ca5(PO)3F]与硫酸反应可以制得普钙(主要成分为Ca(H2PO4)2·H2O和CaSO4),该反应的化学方程式为________________________。
(2)利用焦炭与石膏在高温下反应,可以制得生产硫酸的炉气,该反应的化学方程式为_____________________。
(3)工业制硫酸过程中的SO2的催化氧化反应在________中进行,实际生产中采用___________的条件。
(4)工业上生产水泥的原料为_______,混凝土是______、_______和________等的混合物,钢筋混凝土属于_______________材料。