微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (13分)短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素原子核外电子层数之和是5。A、B两元素原子最外电子层上电子数之和等于C元素原子最外电子层上的电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A和C可以形成化合物CA3;B与D的原子序数之比为3︰4;E原子最外层电子数比次外层电子数少1。请回答:
(1)E在元素周期表的位置为:_▲_
(2)A、B、C、D原子半径从大到小的顺序为:_▲_(填元素符号)
(3)由A、B两种元素组成的分子有多种,其中一种分子含4个原子,且分子为直线型的对称结构,写出其电子式_▲_。
(4)甲由A、B、C、D四种元素组成的无机盐,既可以与盐酸反应又可以与NaOH溶 液反应,其化学式为_▲_。
液反应,其化学式为_▲_。
(5)由A、C、E三种元素组成的化合物C2A6E2是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出该化合物第一步水解反应的离子方程式_▲_。
(6)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程简单表示如下:
①将化合物CA3通入等物质的量混合的FeSO4、Fe2(SO4)3溶液中,生成两种碱,写出该过程的总离子方程式_▲_。
②上述反应生成的两种碱继续作用,得到Fe3O4,该反应的化学方程式为_▲_。
参考答案:(13分)(1)第三周期ⅦA族?(2)C〉N〉O〉H(3)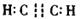
(4)NH4HCO3 [或(NH4)2CO3];?(5)N2H62+ + H2O [N2H5·H2O]+ + H+
[N2H5·H2O]+ + H+
(6)①Fe2+ + 2Fe3++8NH3 +8H2O = Fe(OH)2↓+2Fe(OH)3↓+8NH4+
②Fe(OH)2 +2Fe(OH)3 = Fe3O4 + 4H2O
本题解析:略
本题难度:一般
2、填空题 (15分)已知化合物A与B、丙与丁的元素组成相同,且四种物质中都含有同一种元素。A与B在常温下均呈液态。D与F都为固体单质,且D、 F与甲的浓溶液在常温作用都无明显现象,加热时有大量气体产生。(相关转化部分反应条件和生成物未标出)。
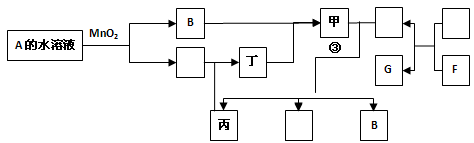
(I)写出A的电子式?。
(II)若反应①除生成甲外还生成丙,写出反应①的化学方程式:?。
(III)若A与丙可以化合生成甲;D与甲的浓溶液加热条件下可以生成三种化合物乙、丙、B,乙、丙、B常温下又可以发生反应④生成甲和另一化合物X。回答下列各小题:
2.写出反应④的离子方程式?。
3.在恒容密闭容器中,反应②达到平衡后,测得如下数据(假设不考虑副反应)。
实验序号
| 温度℃
| 初始C浓度
(mol·L—1)
| 初始丙浓度(mol·L—1)
| C的平衡转化率
|
1
| 510
| 0.8
| 1.2
| A
|
2
| 510
| 1
| 1.2
| 50%
|
3
| 500
| 1
| 1.2
| B
|
①此反应在510℃时平衡常数为?。
②实验l中,A的值?;实验3中,B的值?。(选填序号)
A. 等于50%? B.大于50%? C.小于50%? D.从本题资料,无法判断
③在实验2的平衡体系中,再增加一倍的反应物,平衡将?移动,(填“正向”、“逆向”或“不”)且C的转化率?50%(填“大于”、“小于”或“等于”)
参考答案::(I)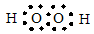 (1分)(II)3NO2 + H2O = 2HNO3 +NO(2分)
(1分)(II)3NO2 + H2O = 2HNO3 +NO(2分)
(III)(1)2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+(2分)
?(2)①50(2分)②B(2分)D(2分)③正向(2分)大于(2分)
本题解析::依题意知A为H2O2,B为H2O, F为铝D为铁,丙为NO丁为NO2,甲为浓硝酸,
3NO2 + H2O = 2HNO3 +NO(2分)(1)2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+
③在实验2的平衡体系中,再增加一倍的反应物,平衡将正向移动,且C的转化率大于
50%。
本题难度:一般
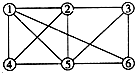
3、选择题 如图所示,6个编号分别代表下列物质中的一种物质,凡是直线相连的两种物质均能发生化学反应(已知高温下氨气能还原氧化铁).图中⑤表示的物质是( )
a.Al;b.Fe2O3;c.NaOH溶液;d.氢碘酸溶液;e.NH3;f.Cl2.
A.a或b
B.c
C.d
D.e或f