微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)图表法、图象法是常用的科学研究方法。短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第_______族。
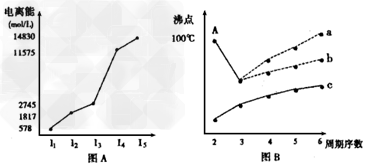
(2)图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可表达第_______族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是:_______?(填“a”或“b”),理由是:___________________________________。
(3)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。试回答下列问题:
I.Ti元素的基态原子的价电子层排布式为______________;
II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;
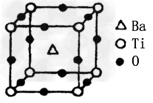
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是_______;晶体内与每个“Ti”紧邻的氧原子数为_______个。
②已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的23。
则绿色晶体配合物的化学式为______________。
参考答案:(1)IIIA
(2)IVA;b;a点所示的氢化物是水,其沸点高是由于在水分子间存在氢键,所以氧族元素中其它氢化物的沸点不会高于水
(3)I.3d24s2;II.①BaTiO3;6;②[TiCl(H2O)5]Cl2·H2O
本题解析:
本题难度:一般
2、简答题 下列性质的比较,正确的是( )
A.酸性:H2SiO3>H2CO3
B.碱性:Mg(OH)2>Al(OH)3
C.稳定性:H2S>HCl
D.原子半径:N>C
参考答案:A.非金属性C>Si,元素非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性:H2CO3>H2SiO3,故A错误;
B.金属性Mg>Al,元素金属性越强,对应的最高价氧化物的水化物的碱性越强,则Mg(OH)2>Al(OH)3,故B正确;
C.非金属性Cl>S,元素非金属性越强,对应的氢化物越稳定,则稳定性:HCl>H2S,故C错误;
D.同周期元素从左到右原子半径逐渐减小,原子半径C>N,故D错误.
故选B.
本题解析:
本题难度:一般
3、选择题 A、B、C、D为四种短周期元素,已知A、C同主族,B、D同周期;A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层。下列叙述正确的是
A.原子序数:A>B>C>D
B.单质熔点:D>B,A>C
C.原子半径:D>B>C>A
D.简单离子半径:D>B>C>A
参考答案:C
本题解析:本题考查元素的位、构、性三者之间的关系。周期表是解决此类问题的工具。
由题意可知A、C为非金属元素,B、D为金属元素。可知位置如下:

所以原子序数:C>B>D>A;熔点:B>D,C>A;原子半径:D>B>C>A,C项正确。简单离子半径:C>A>D >B。所以C项正确。
本题难度:简单
4、选择题 随着核电荷数的递增,氧化性逐渐减弱的一组是
A.I2、Br2、Cl2、F2
B.F2、Cl2、Br2、I2
C.F-、Cl-、Br-、I-
D.Li、Na、K、Rb
参考答案:B
本题解析:
本题难度:简单
5、选择题 短周期元素A、B、C原子序数依次递增,它们的原子的最外层电子数之和为10.A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数.下列叙述正确的是
A.原子半径A<B<C
B.A的氢化物的稳定性小于C的氢化物
C.B与C都可与烧碱溶液反应
D.B在一定条件下能与A的氧化物剧烈反应
参考答案:D
本题解析:由题意知,A为碳,B为镁,C为硅.
本题难度:一般