微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某课外活动小组使用下列用品设计原电池.用品:铜片、铁片、导线、金属夹、发光二极管、果汁(橙汁、苹果汁)500mL,、烧杯.下列说法正确的是( )
A.该装置能将电能转化为化学能
B.实验过程中铜片逐渐溶解
C.电子由铁片通过导线流向铜片
D.铁片上会析出红色的铜
参考答案:A、该装置构成了原电池,所以该装置是将化学能转变为电能的装置,故A错误;
B、实验过程中,较不活泼的金属铜作正极,正极上得电子发生还原反应,故B错误;
C、该原电池放电时,铁作负极,铜作正极,电子由铁片通过导线流向铜片,故C正确;
D、该原电池放电时,铁作负极,负极上较活泼金属铁失电子发生氧化反应,故D错误.
故选C.
本题解析:
本题难度:一般
2、选择题 镍—镉可充电电池可发生如下反应:Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O,由此可知,该电池的负极材料是(?)
Cd+2NiO(OH)+2H2O,由此可知,该电池的负极材料是(?)
A.Cd
B.NiO(OH)
C.Cd(OH)2
D.Ni(OH)2
参考答案:A
本题解析:充电相当于电解池,放电相当于原电池。在原电池中较活泼的金属作负极,失去电子,发生氧化反应。所以根据反应式可知放电时Cd是还原剂,失去电子,作负极,因此答案选A。
本题难度:一般
3、填空题 (10分)某研究性学习小组,为了探究电极与原电池的电解质之间关系,设计了下列实验方案:用铝片、铜片、镁片作电极,分别与下列溶液构成原电池,并接电流表。
(1)若电解质溶液为0.5mol/L硫酸,电极为铜片和铝片,则电流计指针偏向??(填“铝”或“铜”)。
(2)若用浓硝酸作电解质溶液,电极为铜片和铝片,则电流计指针偏向?(填“铝”或“铜”),铝做?(填“正”或“负”),正极上电极反应式为:?
(3)若电解质溶液为0.5mol/L氢氧化钠溶液,电极为镁片和铝片,则正极发生的电极反应为?。
通过上述实验探究,你受到的启示是 ?
?
参考答案:(10分)(1)铝; (2)铜;正, 2NO3-+2e-+4H+=2NO2↑+2H2O
(3)2H2O+2e-=2OH-+H2↑ 启示1,电极类型与电解质溶液性质有关;启示2,金属活泼性相对某溶液而言,不同的物质相对同一种金属,可能活泼性发生变化;启示3,根据电极类型比较金属活泼性不一定正确;启示4,可以通过电流流向确定金属的相对活泼性。
本题解析:(1)电极为铜片和铝片,电解质为硫酸溶液时,负极为铝,电子的流动方向为负极到正极,电流的方向为正极到负极,故电流表指针偏向于铝;(2)浓硝酸做电解质溶液时,铝钝化,故铜做负极,电池反应为铜和浓硝酸反应,正极上是硝酸根离子得电子生成二氧化氮,电极反应式为:2NO3-+2e-+4H+=2NO2↑+2H2O;(3)电解质溶液为0.5mol/L氢氧化钠溶液,电极为镁片和铝片时,因为镁和氢氧化钠不反应,故负极为铝,电池反应为铝和氢氧化钠反应,故正极反应为:2H2O+2e-=2OH-+H2↑;本题的启示主要是负极材料不仅仅决定于金属的活动性,还要考虑电解质溶液,考虑电池反应。
本题难度:一般
4、填空题 (6分)利用碳棒、锌片和200ml稀硫酸组成原电池,将化学能转化为电能,当碳棒上共产生3.36L(标准状况)气体时,硫酸恰好全部被消耗。试计算:
(1)锌片的质量减少了多少?
(2)原稀硫酸溶液的物质的量浓度。
(3)有多少个电子通过了导线。
参考答案:⑴ 9.75g?⑵ 0.75mol/L?⑶ 1.806×1023
本题解析:略
本题难度:简单
5、选择题 设计如下装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu)。恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa"处形成清晰的界面。通电后,可观察到清晰界面缓缓向上移动。下列说法不正确的是
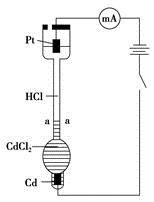
A.通电后,可观察到清晰界面缓缓向上移动的原因是Cd2+向Pt电极迁移的结果
B.装置中Pt电极附近的pH增大
C.一定时间内,如果通过HCl溶液某一界面的总电量为5.0 C,测得H+所迁移的电量为4.1 C,说明该HCl溶液中H+的迁移速率约是Cl-的4.6倍
D.如果电源正负极反接,则下端产生大量Cl2,使界面不再清晰,实验失败
参考答案:D
本题解析:通电后阳离子向阴极移动,A项正确;阴极的电极反应为:2H++2e-===H2↑, 阳极反应为:Cd-2e- ="==" Cd2+ , Pt电极附近的H+被电解,pH增大,B项正确;H+向阴极方向迁移的电量为4.1 C, 则Cd2+通过界面向阴极方向迁移的电量为0.9 C,Cl-通过界面向阳极方向迁移的电量为0.9 C,4.1 C÷0.9 C≈4.6,C项正确;如果电源正负极反接,应是上端产生大量Cl2,D项错误。
本题难度:一般