| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《热化学方程式》试题预测(2017年最新版)(八)
参考答案:C 本题解析:A.由于① C(s)+O2(g)=CO2(g)是放热反应,△H1<0,所以选项A错误;B. ②+③,整理可得:C(s)+O2(g)=CO2(g),故△H1=△H2+ △H3,错误;C.④+2×⑤,整理可得:6CO(g)+3O2(g)=6CO2(g) .即3△H3=△H4 + 2 △H5,正确;D. ①×3+④,整理可得:3C(s)+6O2(g)+ 4Fe(s)=3CO2(g)+ 2Fe2O3(s)。与⑤不等。故△H5与3△H1+△H4不同,错误。 本题难度:一般 3、选择题 已知:C (s)+ O2(g)="CO(g)" H=" -110." 50KJ/mol |
参考答案:B
本题解析:根据盖斯定律,一式×2-二式:-110.50×2+393.5=+172.51 KJ/mol,选B。
考点:考查盖斯定律的应用。
本题难度:一般
4、填空题 (16分)工业常用燃料与水蒸气反应制备H2和CO, 再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.4 kJ·mol-1,下列判断正确的是 。
CO(g)+H2(g) △H=+131.4 kJ·mol-1,下列判断正确的是 。
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g) C(s)+H2O(1) △H=-QkJ·mol-1,则Q<131.4
C(s)+H2O(1) △H=-QkJ·mol-1,则Q<131.4
d.若C(s)+CO2(g) 2CO(g) △H1;CO(g)+H2O(g)
2CO(g) △H1;CO(g)+H2O(g) H2(g)+CO2(g) △H2则:△H1+△H2=+131.4 kJ·mol-1
H2(g)+CO2(g) △H2则:△H1+△H2=+131.4 kJ·mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
| | 不同时间各物质的物质的量/mol | |||
| 0 min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |

参考答案:(1)ad (2)① 0.18mol·L-1·min-1 ② 20%;变小;ad
(3)①阳极 ②6Co3++CH3OH+H2O=6Co2++CO2+6H+。 ③4H++O2+4e-=2H2O 。
本题解析:本题为涵盖多知识点的综合题,各知识点之间相互独立。(1)根据化学反应的焓变确定为吸热反应,结合盖斯定律可知a、d正确,c项生成的水为液体,放热大于131.4kJ/mol;
(2) CH4(g) + H2O(g) CO(g) + 3H2(g)
CO(g) + 3H2(g)
初始量(mol)2.00 1.00 0 0
变化量(mol)0.40 0.40 0.40 1.20
4min时(mol)1.60 n1
6min时(mol)n2 1.20 所以反应4min时达平衡,此时 CH4的转化率为20%;平衡时再冲入2.00mol甲烷和1.00mol水蒸气,物质的转化率降低,导致达到新平衡时H2的体积分数比原平衡小;(3)由题给信息确定a极发生氧化反应,所以为阳极;微生物电池为酸性,所以H+参与正极反应,氧气在该电极发生还原反应,不难确定电极反应式。
考点:化学反应的能量变化、化学反应速率、转化率的计算、原电池、电解池。
本题难度:困难
5、填空题 (13分)工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
① 2H2 (g)+CO(g) 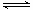 CH3OH (g) ΔH= -90.8 kJ·mol-1
CH3OH (g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g) 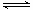 CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g) 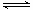 CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
(1)总合成反应的热化学方程式为 。
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是_____(填字母代号)。
A 高温高压 B 加入催化剂 C 减少CO2的浓度
D 增加CO的浓度 E 分离出二甲醚
(3)反应②2CH3OH(g)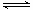 CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验 序号 | 温度 浓度 时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
参考答案:(13分)
(1)3H2(g)+3CO(g) CH3OCH3(g)+CO2 (g) ΔH=-246.4 kJ·mol-1(2分)
CH3OCH3(g)+CO2 (g) ΔH=-246.4 kJ·mol-1(2分)
(2)C E (2分)
(3)①0.013mol/(L·min) (2分)
②1.0(2分),催化剂(1分)
③>(2分),1.2 mol/L(2分)
本题解析:(1)总合成反应的化学方程式为3H2(g)+3CO(g) CH3OCH3(g)+CO2 (g),根据盖斯定律得总反应=①×2+②+③,所以总反应的热化学方程式为3H2(g)+3CO(g)
CH3OCH3(g)+CO2 (g),根据盖斯定律得总反应=①×2+②+③,所以总反应的热化学方程式为3H2(g)+3CO(g) CH3OCH3(g)+CO2 (g) ΔH=-246.4 kJ·mol-1;
CH3OCH3(g)+CO2 (g) ΔH=-246.4 kJ·mol-1;
(2)A、温度升高,平衡逆向移动,CO的转化率降低,错误;B、加入催化剂对平衡无影响,CO的转化率不变,错误;C、减少二氧化碳的浓度,平衡正向移动,CO的转化率增大,正确;D、增加CO的浓度,虽然平衡正向移动,但是CO的转化率降低,错误;E、分离出二甲醚,生成物浓度减小,平衡正向移动,CO的转化率升高,正确,答案选CE;
(3)①实验1,反应在10至20分钟时间内用CH3OH(g)的浓度减少0.80-0.67=0.13mol/L,所以用甲醇表示的平均速率为0.13mol/L/10min="0.013" mol/(L·min);
②实验2与实验1的温度相同,达到的平衡状态相同,但不同的是达到平衡的时间短,所以实验2中的加成的起始浓度与实验1相同,都是1.0mol/L,实验2的反应速率快,但平衡未改变,所以隐含的条件是实验2使用了催化剂;
③根据表中数据可知实验3平衡时CH3OH(g)浓度大于实验1,则实验3的甲醇的起始浓度大于实验1,反应物浓度增大,反应速率加快,所以v3>v1;2CH3OH(g)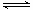 CH3OCH3(g)+H2O(g)是反应前后气体物质的量不变的可逆反应,所以恒温恒容条件下达到的平衡是等效平衡,实验3中甲醇平衡浓度是实验1的0.6/0.5=1.2倍,则起始浓度也是实验1的1.2倍,所以c3=1.2mol/L。
CH3OCH3(g)+H2O(g)是反应前后气体物质的量不变的可逆反应,所以恒温恒容条件下达到的平衡是等效平衡,实验3中甲醇平衡浓度是实验1的0.6/0.5=1.2倍,则起始浓度也是实验1的1.2倍,所以c3=1.2mol/L。
考点:考查化学平衡理论的应用,平衡的计算,等效平衡的判断,盖斯定律的应用
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《物质的量》.. | |