|
高考化学必考知识点《化学平衡》高频试题强化练习(2017年最新版)(二)
2017-08-08 05:59:03
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 可逆反应:3R(气) 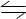 3M(?)十N(?) ( 吸热反应 ),随着温度的升高,气体平均相对分子质量有变小的趋势。则下列判断中正确的是( ) 3M(?)十N(?) ( 吸热反应 ),随着温度的升高,气体平均相对分子质量有变小的趋势。则下列判断中正确的是( )
A.M和N可能都是固体
B.若N为固体.则M一定是气体
C.M和N一定都是气体
D.若M为固体.则N一定是气体
|
参考答案:B
本题解析:气体平均相对分子质量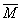 r=气体的总质量/气体的总物质的量,因为正反应是吸热反应,所以温度升高平衡向正反应方向移动,这时气体平均相对分子质量变小。若M和N都是气体,气体质量不变,随着反应的进行,气体物质的量增大,气体平均相对分子质量变小。若M为气体,N不是气体,随着反应的进行,气体物质的量不变,但气体质量变小,所以气体平均相对分子质量变小。若M不是气体,N为气体,则随着反应的进行,气体物质的量变小,气体质量也变小,气体平均相对分子质量如何变化无法判断。若M、N都不是气体,则反应过程中只有R是气体,所以气体始终为纯净物,气体平均相对分子质量为R的相对分子质量,不会变化。所以正确的情况为M一定是气体,N可以是气体,也可以不是,选B。 r=气体的总质量/气体的总物质的量,因为正反应是吸热反应,所以温度升高平衡向正反应方向移动,这时气体平均相对分子质量变小。若M和N都是气体,气体质量不变,随着反应的进行,气体物质的量增大,气体平均相对分子质量变小。若M为气体,N不是气体,随着反应的进行,气体物质的量不变,但气体质量变小,所以气体平均相对分子质量变小。若M不是气体,N为气体,则随着反应的进行,气体物质的量变小,气体质量也变小,气体平均相对分子质量如何变化无法判断。若M、N都不是气体,则反应过程中只有R是气体,所以气体始终为纯净物,气体平均相对分子质量为R的相对分子质量,不会变化。所以正确的情况为M一定是气体,N可以是气体,也可以不是,选B。
考点:考查平均相对分子质量,平衡的移动等知识。
本题难度:一般
2、选择题 下列说法正确的是 ( )
①活化分子间的碰撞一定能发生化学反应
②普通分子有时也能发生有效碰撞
③升高温度会加快反应速率,原因是增加了活化分子的有效碰撞次数
④增大反应物浓度会加快反应速率的原因是单位体积内有效碰撞的次数增多
⑤使用催化剂能提高反应速率,原因是提高了分子的能量,使有效碰撞频率增大
⑥化学反应实质是活化分子有合适取向时的有效碰撞
A.③④⑥
B.①②⑤
C.③④⑤⑥
D.②③④
参考答案:A
本题解析:活化分子间的碰撞不一定能发生化学反应,①错误;只有活化分子才能发生有效碰撞,②错误;使用催化剂能提高反应速率,原因是催化剂可以降低反应的活化能,使有效碰撞频率增大,⑤错误,其余选项都是正确的,答案选A。
点评:该题是中等难度试题的考查,侧重考查学生对活化分子、有效碰撞等有关概念的熟悉了解程度,以及灵活运用基础知识解决实际问题的能力,有利于调动学生的学习兴趣和学习积极性。
本题难度:简单
3、填空题 (18分)研究SO2、NOx、CO等气体的性质对工业生产和环境保护具有重要意义。
(1)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为________________,所得溶液中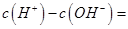 _________ (填字母编号)。 _________ (填字母编号)。

(2)通过NOx传感器可监测大气中NOx的含量,其工作原理如图所示,甲、乙两电极均Pt电极,电解质为熔融氧化物。
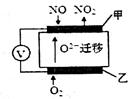
①乙电极上发生的是_________反应(填“氧化”或“还原”);
②甲电极上的电极反应式为___________________。
(3)将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)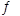 CO2(g)+H2(g) △H,得到如下数据: CO2(g)+H2(g) △H,得到如下数据:

①由表中数据可知该反应的△H________ 0(填“>”或“<”)。
②650℃时,若在此容器中开始充入2mol H2O(g)、lmol CO、1 mol CO2和2 molH2,则反应在开始时_________进行(填“正向”或“逆向”)。
③实验III中a=______,达平衡时实验II和实验III中H2O(g)的转化率的大小关系为: (填“>”、“<”或“=”)。 (填“>”、“<”或“=”)。
参考答案:(18分)
(1)SO2+NH3+H2O===NH4++HSO3-(3分) BD(3分)
(2)①还原(2分)
②NO-2e-+O2-===NO2(2分)
(3)①< (2分) ②正向(2分)
③ 0.6 (2分) >(2分)
本题解析:(1)相同物质的量的SO2与NH3溶于水生成NH4HSO3,所以离子方程式为:SO2+NH3+H2O===NH4++HSO3-;根据电荷守恒可得:c(H+)+c(NH4+)=c(OH?)+c(HSO3?)+2c(SO32?),所以c(H+)—c(OH?)= +c(HSO3?)+2c(SO32?)—c(NH4+),根据物料守恒可得:c(NH4+)+c(NH3?H2O)=c(HSO3?)+c(H2SO3)+c(SO32?),与电荷守恒式相减可得:c(H+)—c(OH?)=c(SO32?)+c(NH3?H2O)—c(H2SO3),故答案为BD。
(2)①根据O22?移动方向可知乙为原电池的正极,发生还原反应。
②根据示意图可知NO在甲电极上与O2?反应生成NO2,电极方程式为:NO-2e-+O2-===NO2。
(3)①对比实验I与实验II数据可知,温度升高,CO的转化率减小,所以正反应为放热反应,故?H < 0。
②根据表中650℃时数据可知:H2O(g)+CO(g)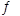 CO2(g)+H2(g) CO2(g)+H2(g)
初始浓度(mol?L?1) 1 2 0 0
转化浓度(mol?L?1) 0.8 0.8 0.8 0.8
平衡浓度(mol?L?1) 0.2 1.2 0.8 0.8
则650℃时平衡常数K=0.8×0.8/(0.2×1.2)=2.67,充入2mol H2O(g)、lmol CO、1 mol CO2和2 molH2,浓度商Q==0.5×1/(1×0.5)="1" < K,所以开始时反应向正反应方向进行。
③根据表中反应II的数据,CO、H2O的转化量为0.4mol,则反应III的转化量也是0.4mol,所以平衡时a=1mol—0.4mol=0.6mol;实验II中H2O的初始量为1mol、CO的初始量为2mol,实验III中H2O的初始量为2mol、CO的初始量为1mol,所以实验IIH2O的转化率大于实验III。
考点:本题考查离子浓度比较、原电池原理、化学平衡常数、化学平衡。
本题难度:困难
4、填空题 联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H2与N2O4反应能放出大量的热。
(1)已知:2NO2(g)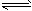 N2O4(g) ΔH=-57.20 KJ·mol-1。在一定温度下,等容密闭容器中反应达到平衡。其它条件不变时,下列措施能提高NO2转化率的是_______ N2O4(g) ΔH=-57.20 KJ·mol-1。在一定温度下,等容密闭容器中反应达到平衡。其它条件不变时,下列措施能提高NO2转化率的是_______
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)已知在T℃,2L密闭容器中,加入4mol NO2(g),发现5分钟末反应达平衡时,放出的热量为
57.20kJ,则此时N2O4的体积分数为_________,在此时间内用N2O4表示的反应速率为____________达平衡后,保持温度不变,快速缩小容器的体积至1 L,气体的颜色变化过程是_____________
(3)25℃时,1.00g N2H4(1)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)==3N2(g)+4H2O(l)的ΔH= ________________ kJ·mol-1。
(4)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、
c(N2O4)=0.0120 mol·L-1。反应2NO2(g)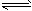 N2O4(g)的平衡常数K=___________ N2O4(g)的平衡常数K=___________
(5)T℃、1.01×105Pa,已知K=1/3,在2L密闭容器中,加入10mol NO2(g) 和4mol N2O4(g),则平衡向生成___________物质的方向移动,再次平衡时,NO2(g)的浓度是_________。
参考答案:(1)BC
(2)33%;0.1mol/(L·min);先加深后变浅,但比原来的要深
(3)-1224.96
(4)13.3
(5)N2O4;3mol/L
本题解析:
本题难度:一般
5、选择题 下列事实中,不能用勒夏特列原理解释的是( )
A.密闭、低温是存放氨水的必要条件
B.实验室常用排饱和食盐水法收集氯气
C.硝酸工业生产中,使用过量空气以提高NH3的利用率
D.合成氨反应采用较高温度和使用催化剂,以提高氨气的产量
参考答案:A.氨气和水的反应为NH3+H2O?NH3.H2O,该反应是可逆反应,所以可以用勒夏特列原理解释,故A不选;
B.氯气和水的反应方程式为:Cl2+H2O?HCl+HClO,该反应是可逆反应,所以可以用勒夏特列原理解释,故B不选;
C.氨气和氧气反应生成一氧化氮的方程式为:4NH4+5O2?4NO+6H2O,该反应是可逆反应,所以可以用勒夏特列原理解释,故C不选;
D.合成氨采用较高的温度是为了提高反应速率,催化剂对化学平衡无影响,所以不能用勒夏特列原理解释,故D选;
故选D.
本题解析:
本题难度:简单
|