微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 25℃时,在0.5L 0.2mol·L-1的HA溶液中,有 0. 01mol的HA电离成离子。求该温度下HA的电离平衡常数和电离度。
参考答案:由题意列出下式:
HA 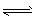 H++A-
H++A-
c初始(mol·L-1) 0.2 ,0 ,0
△c(mol·L-1) 0.02 ,0.02 ,0.02
c平衡(mol·L-1) 0.18 ,0.02 ,0. 02
故HA的电离平衡常数为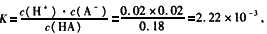
电离度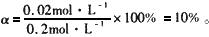
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
[? ]
A.电离平衡常数受溶液浓度的影响
B.电离平衡常数可以表示弱电解质的相对强弱
C.电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大
D.H2CO3的电离常数表达式:K=
参考答案:B
本题解析:
本题难度:一般
3、选择题 A、B两种酸溶液的pH都是2,各取1mL分别加水稀释成1000 mL,其pH的变化如下图所示,则下列判断正确的是
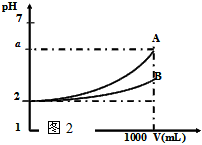
[? ]
A.原酸溶液的浓度c(A)=c(B)
B.若a=5,则A为强酸,B为弱酸
C.原酸溶液的浓度c(A)>c(B)
D.若2<a<5,则A、B都是弱酸,酸性A<B
参考答案:B
本题解析:
本题难度:一般
4、简答题 常温下c(H+)=0.1mol/L的两种一元酸HX和HY的溶液各50mL,分别加入足量的镁粉,充分反应后,收集H2的体积为V(HX)和V(HY),若V(HX)>V(HY),则(用“<”“>”或“=”填空):
(1)浓度:c(HX)______c(HY);?酸性强弱:HX______HY;
(2)则开始时生成氢气的速率:v(HX)______v(HY),反应过程中生成氢气的速率:v(HX)______v(HY),反应完毕后溶液中盐的浓度:c(MgX2)______c(MgY2).
参考答案:(1)由H原子守恒知,生成的氢气体积越大,所用酸的物质的量越多,若溶液的体积相同时,酸的物质的量越多,溶液的浓度越大,所以c(HX)>c(HY);?
因为c(HX)>c(HY),两溶液中c(H+)相等,所以HX的电离程度小于HY的电离程度,电离程度越大,酸的酸性越强,所以HX 的酸性小于HY的酸性;
故答案为:>;<;
(2)离子的浓度越大,反应速率越快,刚开始时,氢离子浓度相同,所以反应速率相等;随着反应的进行,氢离子浓度减小,弱酸电离出氢离子补充减少的离子,所以HX 的氢离子浓度大于HY的氢离子浓度,所以反应过程中生成氢气的速率:v(HX)>v(HY);溶液中c(HX)>c(HY),根据氯原子守恒知,与足量镁反应后溶液中盐的浓度
c(MgX2)>c(MgY2),故答案为:═;>;>.
本题解析:
本题难度:一般
5、选择题 下列说法中正确的是( )
A.在Na3PO4溶液中,c(Na+)?是c(PO43-)的3倍
B.pH=3的盐酸中,其c(H+)是pH=1的盐酸的3倍
C.0.1mol/L?KOH溶液和0.1mol/L氨水中,其c(OH-)相等
D.在25°C时,无论是酸性、碱性还是中性溶液中,其c(H+)和c(OH-)的乘积都等于1×10-14
参考答案:A.钠离子不水解而磷酸根离子水解,所以Na3PO4溶液中,c(Na+)?大于c(PO43-)的3倍,故A错误;
B.盐酸是强酸,pH=3的盐酸中,c(H+)=10-3,pH=1的盐酸溶液中,c(H+)=10-1,所以pH=3的盐酸中,其c(H+)是pH=1的盐酸的1%,故B错误;
C.氢氧化钾是强碱,氨水是弱碱,0.1mol/L的KOH溶液和0.1mol/L氨水中,氢氧化钠中c(OH-)=0.1mol/L,氨水中c(OH-)<0.1mol/L,所以两种溶液中c(OH-)不等,故C错误;
D.水的离子积常数只与温度有关,与溶液的酸碱性无关,故D正确;
故选D.
本题解析:
本题难度:简单