微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 反应A+3B=2C+D在四种不同情况下的反应速率分别为:
①v(A) =0.15mol/(L·s) ②v(B)=0.6mol/(L·s) ③v(C)=0.5mol/(L·s) ④v (D) =0.45mol/(L·s)
则反应进行由快到慢的顺序为
[? ]
A.④>③>①>②
B.②>④>③>①
C.②>③>④>①
D.④>③>②>①
参考答案:D
本题解析:
本题难度:简单
2、计算题 某温度时,在5?L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。
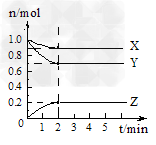
(1)反应开始至2mim,Y的平均反应速率为________mol·(L·min)?-1。
(2)分析有关数据,写出X、Y、Z的反应方程式_____________。 ?
(3)写出提高Y的转化率的两个措施_________和_________。
参考答案:解:(1)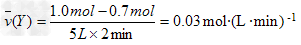
(2)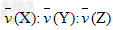 =△n(X):△n(Y):△n(Z)=0.1mol:0.3mol:0.2mol=1:3:2
=△n(X):△n(Y):△n(Z)=0.1mol:0.3mol:0.2mol=1:3:2
反应方程式是:X(g)+3Y(g) 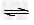 2Z(g)?
2Z(g)?
(3)①增大压强;②提高X的浓度。(或减小Z的浓度,合理即可)
本题解析:
本题难度:一般
3、填空题 物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为_______。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)____________________________________。
(3)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s) Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
参考答案:(8分) (每空2分)
(1)c(NH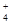 )>c(SO
)>c(SO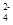 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
(2)HCO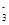
 H++CO
H++CO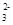 ;HCO
;HCO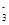 +H2O
+H2O H2CO3+OH-;
H2CO3+OH-;
(3)②①③ ;? 6×10-10mol·L-1
本题解析:(1)铵根离子水解,溶液呈酸性,c(H+)>c(OH-),.1mol?L-1的(NH4)2SO4溶液中,铵根离子水解微弱,所以得到溶液中的离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-)。
(2)在NaHCO3溶液中存在碳酸氢根离子的水解平衡为:HCO3+H2O H2CO3+OH-,电离平衡为:HCO3-
H2CO3+OH-,电离平衡为:HCO3- H++CO32-;水的电离平衡,H2O
H++CO32-;水的电离平衡,H2O H++OH-。
H++OH-。
(3)Ksp=1.8×10-10mol2?L-2=C(Ag+)?C(Cl-),通过计算分别得到:①100mL蒸馏水中含银离子浓度和氯离子浓度相同;②100mL 0.2mol?L-1AgNO3溶液中Ag+浓度为0.2mol/l抑制沉淀溶解平衡,氯离子浓度=1.8×10-10÷0.2=9×10-10mol/L;③100mL 0.1mol?L-1氯化铝溶液中氯离子浓度为0.3mol/L,银离子浓度=6×10-10mol/L;④100mL 0.1mol?L-1盐酸溶液中氯离子浓度为0.1mol/L,银离子为1.8×10-9mol/L;综上所述大小顺序为:②①④③;②中氯离子的浓度9×10-10 mol/L;,③中银离子的浓度:6.0×10-10mol/L。
点评:本题考查了盐类水解的应用,溶液中离子浓度大小的比较,溶液中平衡的分析,溶液配制,溶度积的计算应用。
本题难度:一般
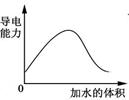
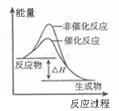
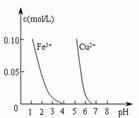
4、选择题 下列图示与对应的叙述相符的是
 ?
? ?
? ?
?
图Ⅰ?图Ⅱ?图Ⅲ?图Ⅳ
A.图Ⅰ表示t℃时冰醋酸在稀释过程中溶液导电性的变化
B.图Ⅱ表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图Ⅲ表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的大
3C(g)+D(s)的影响,乙的压强比甲的大
D.据图Ⅳ,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右
参考答案:D
本题解析:A中,冰醋酸的导电性应该为0,所以A错误;B中,表示的应该为放热反应分别在有、无催化剂的情况下反应过程中的能量变化,不是吸热,所以B错误;C中错在乙的压强比甲的大,因为对可逆反应2A(g)+2B(g) 3C(g)+D(s),压强越大,反应物的百分比就越小,但是最终的百分比并不相等,故C错误;D项则是正确选项
3C(g)+D(s),压强越大,反应物的百分比就越小,但是最终的百分比并不相等,故C错误;D项则是正确选项
点评:该题具有一定的综合性,并且还结合了图像,是高考考查的重点,具有一定的难度。
本题难度:一般
5、选择题 在一定温度下的密闭容器中,加入1 mol CO和1 mol H2O,发生反应:CO(g)+H2O(g)  CO2(g)+H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的是( )
CO2(g)+H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的是( )
A.在该温度下平衡常数K=1
B.平衡常数与反应温度无关
C.CO的转化率为50%
D.其他条件不变改变压强平衡不移动
参考答案:B
本题解析:反应CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
起始物质的量? 1? 1? 0? 0
变化物质的量? 0.5? 0.5? 0.5? 0.5
平衡物质的量? 0.5? 0.5? 0.5? 0.5
A正确;B错,平衡常数受温度影响;C正确;D正确;
本题难度:一般