微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (6分)将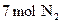 和
和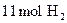 在适宜条件下按下式进行反应
在适宜条件下按下式进行反应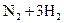

 ,当在某
,当在某 一温度下达到化学平衡状态,试解答:
一温度下达到化学平衡状态,试解答:
(1)若测得平衡混合气体对空气的相对密度为0.6时,求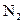 的转化率.
的转化率.
(2)若测得平衡混合气体对空气的相对密度为0.47时,求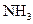 在平衡混合气体中体积分数.
在平衡混合气体中体积分数.
参考答案:(1)39%? (2)12.5%
本题解析:略
本题难度:一般
2、选择题 在373K?时,把0.5mol?N2O4气体通入体积为5L的真空密闭容器中,立即出现红棕色.N2O4?2NO2,反应进行到2s时,NO2的浓度为0.02mol/L.在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍.下列说法正确的是( )
A.前2?s,以N2O4浓度变化表示的平均反应速率为0.01?mol?L-1?s-1
B.平衡时,若往容器内充入二氧化氮气体,则可提高N2O4的转化率
C.平衡时,体系内含N2O4?0.25?mol
D.在2?s时,体系内压强为反应前的1.1倍
参考答案:A.2秒时,NO2的浓度为0.02摩/升,则转化的N2O4的浓度为0.01mol/L,则前2秒,以N2O4的浓度变化表示的平均反应速度为0.01mol/L2s=0.005mol/L.s,故A错误;
B.平衡时,若往容器内充入二氧化氮气体,相当于在原来的基础上缩小体积,由N2O4═2NO2,则缩小体积,压强增大,化学平衡逆向移动,N2O4的转化率降低,故B错误;
C.设转化的N2O4的物质的量为x,则平衡时N2O4的物质的量为0.5mol-x,NO2的物质的量为2x,由平衡时容器内压强为开始时的1.6倍,则0.5mol-x+2x0.5mol=1.6,解得x=0.3mol,则平衡时N2O4的物质的量为0.5mol-x=0.5mol-0.3mol=0.2mol,故C错误;
D.由N2O4═2NO2,2秒时NO2的物质的量为0.1mol,N2O4的物质的量为0.5mol-0.01mol/L×5L=0.45mol,由反应前后的物质的量之比等于压强之比,则在2秒时体系内的压强为开始时的0.1mol+0.45mol0.5mol=1.1倍,故D正确;
故选D.
本题解析:
本题难度:一般
3、选择题 在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)  ?C(g)+D(g)已达到平衡状态?
?C(g)+D(g)已达到平衡状态?
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A.①②③④⑤⑥⑦⑧?B.①③④⑤
C.①②③④⑤⑦ ?D.①③④⑤⑧⑨
参考答案:B
本题解析:要理解化学平衡状态的特点“等、动、定”的含义,在判断化学平衡状态时还要注意反应前后气体体积是否相等。题给反应是一个反应前后气体体积不相等的反应,因此在定容容器中,若①混合气体的压强、③B的物质的量浓度、④混合气体的总物质的量、⑤混合气体的平均相对分子质量不再变化,均能证明该反应达到化学平衡状态。而②中ρ=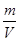 始终不变化,⑥中没指明反应进行的方向,⑦m(g)始终不变化,⑧在定容容器中,混合气体的总体积不能作为判断依据,⑨反应未达到平衡状态时,C、D气体的分子数之比也可能为1∶1。
始终不变化,⑥中没指明反应进行的方向,⑦m(g)始终不变化,⑧在定容容器中,混合气体的总体积不能作为判断依据,⑨反应未达到平衡状态时,C、D气体的分子数之比也可能为1∶1。
本题难度:一般
4、选择题 在恒温恒容条件下,有反应2A(g)+2B(g) 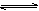 ?C(g)+3D(g),现分别从两条途径建立平衡:I.A、B的起始浓度均为2 mol·L-1?Ⅱ.C、D的起始浓度分别为2 mol·L-1和6 mol·L-1.下列说法正确的是(? )
?C(g)+3D(g),现分别从两条途径建立平衡:I.A、B的起始浓度均为2 mol·L-1?Ⅱ.C、D的起始浓度分别为2 mol·L-1和6 mol·L-1.下列说法正确的是(? )
A.达到平衡时,I途径的反应速率和Ⅱ途径的反应速率相同
B.达平衡时,体系内混合气体的平均密度相同
C.I、Ⅱ两途径达到平衡时,体系内混合气体的百分组成相同
D.I、Ⅱ两途径达到平衡时,体系内混合气体的平均相对分子质量不同
参考答案:C
本题解析:恒温恒容时,反应前后计量数不变的反应,若起始投料量比值相等,则两平衡等效。II中C、D的起始浓度分别为2 mol·L-1和6 mol·L-1相当于A、B的起始浓度均为4mol/L。I中A、B起始浓度均为2mol/L,达平衡时,II途径的反应速率比I途径快,A错误;达到平衡时,II中混合气体的密度是I的2倍,B错误;两途径达到平衡时是等效平衡,平衡时混合气体的百分组成相同、混合气体的平均相对分子质量相同,C正确、D错误。
点评:定温定容建立等效平衡的条件是投料量相等,对于反应前后气体化学计量数不变的反应,建立等效平衡的途径是起始投料量比值相等。
本题难度:一般
5、填空题 (14分)
(1)某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)=2NO2(g)?△H1=+68kJ/mol?
N2H4(g)+O2(g)=N2(g)+2H2O(l)?△H2=-534kJ/mol
请写出该次发射火箭时燃烧反应的热化学方程式?。
(2)下表是不同温度下水的离子积数据:
温度/℃
| 25
| t1
| t2
|
水的离子积常数
| 1×10-14
| a
| 1×10-12
|
若25<t1<t2,则a ? 1×10-14(填“>”、“<”或“=”);?
t2℃下,某Na2SO4溶液中c(SO)=5×10-4 mol·L-1,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)= 。
(3)牙齿表面由一层硬的、组成为Ca5(PO4)3OH的羟基磷灰石保护着,它在唾液中存在平衡:Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO(aq)+OH-(aq);Ksp=2.5×10-59。进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。
5Ca2+(aq)+3PO(aq)+OH-(aq);Ksp=2.5×10-59。进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。
已知Ca5(PO4)3F的Ksp=2.8×10-61,比Ca5(PO4)3OH质地更坚固。请写出当牙膏中配有氟化物添加剂后能防止龋齿的原因: 。(用离子方程式表示及简要的文字解释)
(4)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,?c(NO2)=0.50mol/L、c(N2O4)="0.125" mol/L。则2NO2(g) N2O4(g)的平衡常数K=?。若NO2起始浓度为2 mol/L ,相同条件下,NO2的最大转化率为?。
N2O4(g)的平衡常数K=?。若NO2起始浓度为2 mol/L ,相同条件下,NO2的最大转化率为?。
参考答案:(1)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)?△H=-1136kJ/mol
(2)>; 100∶1
(3)有机酸长时间跟牙齿表面密切接触,使平衡向沉淀溶解的方向移动;
牙膏里的氟离子会与羟基磷灰石发生沉淀转化,生成氟磷灰石:
Ca5(PO4)3OH+F-===Ca5(PO4)3F+OH-
(4)0.50 L/mol?50%
本题解析:(1)根据盖斯定律可知,②×2-①即得到2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l),所以反应热是△H=-534kJ/mol×2-68kJ/mol=-1136kJ/mol。
(2)电离是吸热的,所以随着温度的升高,水的离子积常数是增大,因此a>1×10-14;硫酸钠溶液显中性,所以c(OH-)=1×10-6 mol·L-1。溶液中c(Na+)=5×10-4 mol·L-1×2÷10=1×10-4 mol·L-1,所以c(Na+)∶c(OH-)==100︰1。
(3)由于有机酸长时间跟牙齿表面密切接触,使平衡向沉淀溶解的方向移动,所以牙齿就会受到腐蚀;由于Ca5(PO4)3F的Ksp小于Ca5(PO4)3OH的,所以牙膏里的氟离子会与羟基磷灰石发生沉淀转化,生成氟磷灰石,方程式为Ca5(PO4)3OH+F-===Ca5(PO4)3F+OH-。
(4)由于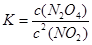 ,所以该温度下,K=
,所以该温度下,K=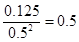 ;设NO2的最大转化率为x,则有
;设NO2的最大转化率为x,则有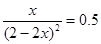 ,解得x=0.5,即转化率是50%。
,解得x=0.5,即转化率是50%。
本题难度:一般