微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是
A.直径介于1 nm ~ 100 nm之间的微粒称为胶体
B.电泳现象可证明胶体带电
C.用渗析的方法可以除去淀粉溶液中的氯化钠
D.用含1 mol FeCl3的溶液可制得6.02×1023个Fe(OH)3胶体粒子
参考答案:C
本题解析:
本题难度:一般
2、填空题 X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电
子排布中,p轨道上只有1个未成对电子。
③Z+与Y 2-具有相同的电子层结构;
请回答:
(1)Z2Y2的电子式为?,含有的化学键类型为?,Z2Y2为?晶体。
(2)X、Y、Z三种元素所形成的常见化合物的名称为?;XY2的结构式为?,分子的立体构型为?。
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是?(填名称);晶体ZW的熔点比晶体XW4明显高的原因是?。
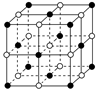
(4)ZW晶体的结构示意图如图。已知:ZW晶体的密度为ρ,摩尔质量为M,阿伏伽德罗常数为NA,则ZW晶体中两个最近的Z离子中心间的距离d可以表示为d=?。
参考答案:(每空2分). (1)  ?离子键、非极性共价键, 离子
?离子键、非极性共价键, 离子
(2)? 碳酸钠,,直线形?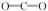
(3) 金刚石;? NaCl为离子晶体而CCl4为分子晶体? (4)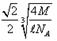
本题解析:X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的,所以X应该是第ⅣA族元素的碳元素。Y元素是地壳中含量最多的元素,因此Y是氧元素。W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子,且W的原子序数大于氧元素的,所以W是氯元素。Z+与Y 2-具有相同的电子层结构,则Z是钠元素。在氯化钠晶胞中含有4个钠离子和4个氯离子,设晶胞的边长是x,则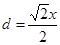 。又因为
。又因为 ,解得d=
,解得d=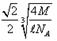 。
。
点评:该题是高考中的常见考点,属于基础性试题的考查。试题综合性强,难易适中,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生灵活运用基础知识解决实际问题的能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
3、简答题 C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)32号元素Ge的原子核外电子排布式为 ??;
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是??;
(3)已知SnO2是离子晶体,写出其主要物理性质???;(写出2条即可)
(4)已知:
?
| CH4
| SiH4
| NH3
| PH3
|
沸点(K)
| 101.7
| 161.2
| 239.7
| 185.4
|
分解温度(K)
| 873
| 773
| 1073
| 713.2
|
分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是?;
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是 ?;
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时?;
(5))用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
(6)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。
参考答案:(1)[Ar]3d104s24p2
(2)Sn
(3)熔沸点较高,硬度较大
(4)①CH4和SiH4比较,相对分子质量越大,范德华力越大,故沸点高,而NH3和PH3比较前者分子间存在氢键沸点高
②分解破坏的均为共价键,C-H的键能大于Si-H的键能,N-H键的键能大于P-H键的键能;HF。
(5)<
(6)PbBaO3? 12
本题解析:(1)Ge的原子序数为32,则电子排布式为[Ar]3d104s24p2,故答案为:[Ar]3d104s24p2;
(2)C、Si、Sn随原子序数增大,非金属性减弱,金属性增强,只有Sn为金属,则Sn为金属晶体,故答案为:Sn;
(3)离子晶体熔沸点较高,硬度较大,熔融状态能导电等性质,故答案为:熔沸点较高,硬度较大;
(4)①CH4和SiH4比较,相对分子质量大的沸点高,而NH3和PH3比较,氨气中含有氢键沸点大,
故答案为:CH4和SiH4比较,相对分子质量越大,范德华力越大,故沸点高,而NH3和PH3比较前者分子间存在氢键沸点高;
②由键长越短,键能越大,越稳定,分解温度就越高可知,分解破坏的均为共价键,C-H的键能大于Si-H的键能,N-H键的键能大于P-H键的键能,
故答案为:分解破坏的均为共价键,C-H的键能大于Si-H的键能,N-H键的键能大于P-H键的键能;
一定压强下,沸点高的气体先液化,HF分子之间存在氢键,沸点高,则HF和HCl的混合气体降温时HF先液化,
故答案为:HF。
(5)SnBr2分子中,Sn原子的价层电子对数目是(4+2)/2=3,配位原子数为2,故Sn含有孤对电子,SnBr2空间构型为V型,键角小于120°。
(6)根据均摊法可知,每个晶胞含有Pb4+:8×1/8=1个,Ba2+:1个,O2-:12×1/4
=3个,故化学式为PbBaO3,Ba2+处于晶胞中心,只有一个,O2-处于晶胞棱边中心,共有12个,故每个Ba2+与12个O2-配位。
本题难度:一般
4、选择题 下列四种元素中,其单质氧化性最强的是
A.原子含未成对电子最多的第二周期元素
B.原子最外层电子排布为2s22p4的元素
C.位于周期表中第三周期ⅢA族的元素
D.原子最外层电子排布为3s23p3的元素
参考答案:B
本题解析:根据元素的结构、位置和核外电子的排布规律可知,A是N、B是O、C是Al,D是P。 www.91eXam.org因此单质氧化性最强的是氧气,答案选B。
本题难度:一般
5、填空题 (21分)下表是元素周期表的一部分,回答有关问题。
?
| ?ⅠА
| ?ⅡА
| ?ⅢА
| ?ⅣА
| ?ⅤА
| ⅥА
| ?ⅦА
| ? 0
|
? 2
| ?
| ?
| ?
| ?
| ?①
| ?
| ?②
| ?
|
? 3
| ?③
| ?④
| ?⑤
| ?⑥
| ?
| ?⑦
| ?⑧
| ?⑨
|
? 4
| ?⑩
| ? 11
| ?
| ?
| ?
| ?
| ? 12
| ?
|
(1)在这些元素中,最活泼的金属元素是(均用元素名称填写)?—、最活泼的非金属元素是?、最不活泼的元素是?
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是(均用化学式填写)?、碱性最强的是?,呈两性的氢氧化物是?,写出三者之间两两相互反应的离子方程式?
(3)在这些元素中,原子半径最大的是?—、原子半径最小的是?(均用元素符号填写)
(4)写出②与④形成化合物的电子式?;写出①单质的电子式?;
参考答案:(1)钾?氟?氩(每空1分)
(2)HClO4? KOH? Al(OH)3 ?
H+ + OH -= H2O? 3H+ + Al(OH)3 ?=? Al3+ + H2O?
OHˉ+ Al(OH)3 ?=? [Al(OH )4]ˉ(每空2分)
(3)? K? F (每空1分)
(4)氟化镁的电子式;氮气的电子式(每空2分)
本题解析:(1)题可以根据元素周期律,同周期从左到右元素金属性逐渐减弱,非金属性逐渐增强,同主族元素从上到下元素金属性逐渐增强,非金属性逐渐减弱,得出相应答案。
(2)题可以由最高价氧化物对应水化物的酸性和碱性强弱的判断依据,即非金属性越强酸性越强,金属性越强碱性越强。
(3)依据电子层数越多半径越大,电子层数相同时,原子序数越大半径越小得出答案。
(4)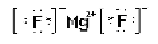 ?
?
本题难度:一般