微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (18分)某中学化学课外活动小组欲探究铁在氯气中燃烧产物的成份、性质和用途,设计了如下实验步骤:
Ⅰ、用下列实验装置制取纯净干燥的氯气
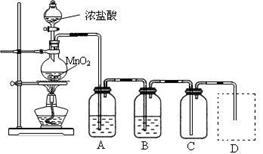
写出A、B中所盛放最佳化学试剂的名称?、?,画出虚线框内所需装置图并标明所需试剂的名称。
Ⅱ、某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分。探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②:?;假设③:?。
(2)设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空。
?实验方法
| 实验现象
| 结论
|
在溶液中加
KSCN溶液
| ?
| 固体物质中有FeCl3
|
向a溶液中滴加
酸性KMnO4溶液
| KMnO4溶液紫色
不褪色
| 固体物质中不含______
|
由此得出结论:假设?成立(填序号①②③)。
Ⅲ、为进一步探究物质a的性质,他们又利用a溶液做了如下一些实验,其中现象、结论均正确的是_____________(填写序号)
A.向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,证明Ksp[Fe(OH)3]< Ksp[Mg(OH)2]
B.向a溶液中加入少量铁粉,铁粉溶解,溶液颜色由浅绿色变成黄色
C.向沸水中滴加a的饱和溶液,立即出现红褐色沉淀
D.将a溶液加热蒸干并灼烧,得到Fe2O3固体
IV、a溶液常作印刷电路铜板的腐蚀剂,写出发生反应的离子方程式?。活动小组的同学们又设计了两种从上述废液中回收Cu的方案:
方案1:设计流程图如下:

请分别写出操作①和试剂②的名称_________,_______。
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解,铜作________极。当观察到阴极有少量气泡产生时,停止电解,这时要回收的Cu已全部析出。
评价:方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:?。
参考答案:(共18分)
Ⅰ、饱和食盐水(1分);浓硫酸(1分);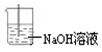 其它合理装置也对(2分)
其它合理装置也对(2分)
Ⅱ、(1)FeCl2(1分);FeCl3和FeCl2的混合物(1分)
(2)
实验方法
实验现象
结论
在溶液中加
KSCN溶液
溶液为红色(1分)?
固体物质中有FeCl3
向a溶液中滴加
酸性KMnO4溶液
KMnO4溶液紫色
不褪色
固体物质中不含FeCl2(1分)
本题解析:略
本题难度:一般
2、选择题 除去乙烷中少量乙烯的最好方法是( )
A.通过足量的溴的四氯化碳溶液
B.通过足量的溴水
C.先通过足量的酸性高锰酸钾溶液,再通过碱石灰
D.催化加氢
参考答案:A.通过足量的溴的四氯化碳溶液,乙烯与溴发生加成反应,乙烷部分溶于四氯化碳,且气体中可能混有溴蒸汽和水蒸气;
B.通过足量的溴水,可除去乙烯,但乙烷中可能混有溴蒸汽和水蒸气;
C.先通过足量的酸性高锰酸钾溶液,乙烯被氧化生成二氧化碳气体,再通过碱石灰,气体中的水、二氧化碳可被吸收,进而得到纯净的乙烷;
D.催化加氢要求高温高压条件,在实验室中难以完成,且不能确定乙烯的量的多少,易得到乙烷和氢气的混合物.
综上分析,最好的方法为C,
故选C.
本题解析:
本题难度:一般
3、选择题 利用下列实验装置能完成相应实验的是
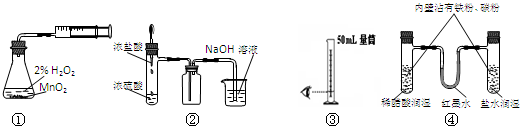
A.装置①测定化学反应速率
B.装置②制取并吸收HCl
C.装置③量取8.5mL的稀硫酸
D.装置④模拟铁的腐蚀
参考答案:D
本题解析:
正确答案:D
A、无法测时间;B、极易引起倒吸;C、应用10ml的量筒;D、正确。
本题难度:一般
4、实验题 目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境。这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验。
【实验Ⅰ】 硫的质量确定:
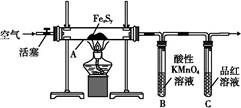
按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.0 g铁硫簇结构(含有部分不反应的杂质),在试管B中加入50 mL 0.1 mol·L-1的酸性KMnO4溶液,在试管C中加入品红溶液。通入空气并加热,发现固体逐渐转变为红棕色。待固体完全转化后将B中溶液转移至250 mL容量瓶,洗涤试管B后定容。取25.00 mL该溶液用0.01 mol·L-1的草酸(H2C2O4)进行测定剩余KMnO4溶液浓度的滴定。记录数据如下:
滴定次数
| 待测溶液
体积/mL
| 草酸溶液体积/mL
|
滴定前刻度
| 滴定后刻度
|
1
| 25.00
| 1.50
| 23.70
|
2
| 25.00
| 1.02
| 26.03
|
3
| 25.00
| 0.00
| 24.99
|
相关反应:①2Mn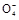 +2H2O+5SO2
+2H2O+5SO2 2Mn2++5S
2Mn2++5S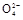 +4H+
+4H+
②2Mn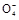 +6H++5H2C2O4
+6H++5H2C2O4 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
【实验Ⅱ】 铁的质量确定:
将实验Ⅰ硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.6 g固体。
试回答下列问题:
(1)检查“实验Ⅰ”中装置气密性的方法是?。
(2)滴定终点的判断方法是?。
(3)试管C中品红溶液的作用是?。
有同学提出,撤去C装置,对实验没有影响,你的看法是 (选填“同意”或“不同意”),理由是?。
(4)根据实验Ⅰ和实验Ⅱ中的数据可确定该铁硫簇结构的化学式为?。
【问题探究】 滴定过程中,细心的小明发现该KMnO4颜色褪去的速率较平常滴定时要快得多。为研究快的原因,甲同学继续进行了下列实验,实验数据如下表:
编号
| 温度/℃
| 酸化的H2C2O4
溶液/mL
| KMnO4
溶液/mL
| 溶液褪
色时间/s
|
1
| 25
| 5.0
| 2.0
| 40
|
2
| 25
| 5.0(另加少量可溶
于水的MnSO4粉末)
| 2.0
| 4
|
3
| 60
| 5.0
| 2.0
| 25
|
?
(5)分析上述数据,滴定过程中反应速率较快的一种可能原因是?。
参考答案:(1)在试管C中加入少量水,关闭活塞,用手捂住硬质玻璃管A(或用酒精灯微热),C中有气泡产生,松开手(或撤去酒精灯),有水进入导气管并形成一段水柱,证明气密性良好
(2)当滴入最后一滴草酸溶液时,锥形瓶中溶液紫红色立即变为无色,且半分钟不变色
(3)验证SO2是否被酸性KMnO4溶液完全吸收
同意 B中溶液不褪色,即可证明SO2已被酸性KMnO4溶液完全吸收
(4)Fe3S4
(5)生成的Mn2+对反应起到催化作用(或反应放热使温度升高,加快反应速率)
本题解析:(4)第1次H2C2O4溶液体积误差较大,舍去。第2、3次取平均值。V(H2C2O4)="25.00" mL。与H2C2O4反应的KMnO4的物质的量为:0.01 mol·L-1×0.025 L×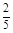 ×10="0.001" mol,与SO2反应的KMnO4的物质的量为:0.05 L×0.1 mol·L-1-0.001 mol="0.004" mol,n(SO2)="0.004" mol×2.5="0.01" mol,n(S)="0.01" mol×32 g·mol-1="0.32" g;0.6 g固体为Fe2O3,n(Fe)=
×10="0.001" mol,与SO2反应的KMnO4的物质的量为:0.05 L×0.1 mol·L-1-0.001 mol="0.004" mol,n(SO2)="0.004" mol×2.5="0.01" mol,n(S)="0.01" mol×32 g·mol-1="0.32" g;0.6 g固体为Fe2O3,n(Fe)=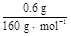 ×2 mol="0.007" 5 mol,m(Fe)="0.007" 5 mol×56 g·mol-1="0.42" g;
×2 mol="0.007" 5 mol,m(Fe)="0.007" 5 mol×56 g·mol-1="0.42" g;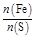 =
=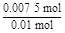 =
=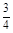 ,所以该铁硫簇结构的化学式为Fe3S4。(5)1、2对比,增加Mn2+,反应速率加快;1、3对比,温度升高,反应速率加快。
,所以该铁硫簇结构的化学式为Fe3S4。(5)1、2对比,增加Mn2+,反应速率加快;1、3对比,温度升高,反应速率加快。
本题难度:一般
5、实验题 “阳光”牌小包装“脱氧剂”成分为Fe粉、活性炭及少量NaCl、水。某校化学兴趣小组欲探究该“脱氧剂”中Fe粉和活性炭质量之比,设计并进行了如下探究过程,请你参与实验并回答下列有关问题。
步骤(1)取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末。由此得出的结论为上述“脱氧剂”中的铁已部分被_______________________;
步骤(2)将步骤(1)中的固体溶于水,过滤,将滤渣洗涤、干燥。该步骤的目的是____________________;
步骤(3)取步骤(2)中的滤渣,将其分为两等份,每一份质量为8.0g。将其中一份在氧气流中充分灼烧,生成的气体全部通人足量的澄清石灰水,得到干燥、纯净的沉淀20.0 g。8.0 g滤渣中活性炭的质量为_____________;
步骤(4)将步骤(3)中的另一份滤渣放入烧杯中,加入一定体积2.0 mol/L的稀H2SO4,微热至反应完全,滤出不溶物。
步骤(5)向步骤(4)中的滤液中加入过量的氢氧化钠溶液,得到的固体经洗涤后转移到坩埚中充分加热,冷却、称量,得到6.86g固体。
结论:该“脱氧剂”中的Fe粉和活性炭质量之比约为___________。
参考答案:氧化;除去氯化钠;2.49;2:1
本题解析:
本题难度:一般