微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
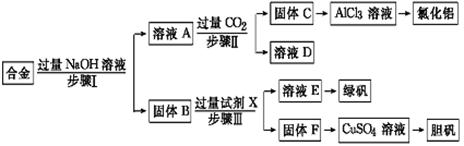
请回答:
(1)写出步骤Ⅰ反应的离子方程式:?。
(2)试剂X是?。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是?。
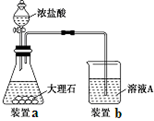
(3)进行步骤Ⅱ时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是?。
(4)用固体F制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式?,请选出你认为的最佳途径并说明选择的理由?。
参考答案:
(1)2Al+2OH—+2H2O=2AlO2-+3H2↑(2分)
(2)稀硫酸或H2SO4(2分)?过滤(2分)
(3)在装置Ⅰ、Ⅱ之间增加一个盛有饱和NaHCO3溶液的洗气瓶(合理答案即给分)(2分)
(4)3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O(2分)?途径②最佳,理由是原料利用率高,环境污染小(2分,结论1分,理由1分)
本题解析:(1)铝、铁、铜中铝与氢氧化钠反应,产生偏氯酸钠和氢气;(2)步骤Ⅲ分离铜、铁,且生成绿矾(硫酸亚铁),故x为稀硫酸;固液分离用过滤;(3)由于浓盐酸易挥发,制备的二氧化碳中含有HCl气体,导致生成的氢氧化铝溶解;为了避免固体减少,可采取的除去HCl气体的方法,在装置Ⅰ、Ⅱ之间增加一个盛有饱和NaHCO3溶液的洗气瓶;(4)途径①③产生NO、SO2污染性气体,途径②最佳,理由是原料利用率高,环境污染小。
本题难度:一般
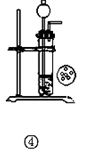
2、选择题 下列实验装置或操作正确的是 (? )
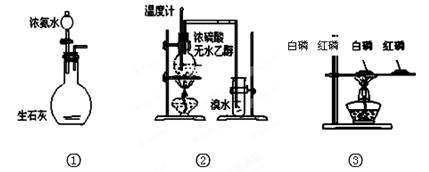
A.实验① 制取氨气
B.实验② 溴水褪色证明了乙烯可以与溴发生加成反应
C.实验③ 比较红磷和白磷的着火点
D.实验④ 用CaC2和饱和食盐水反应制取C2H2
参考答案:A
本题解析:①浓氨水与生石灰可以制取氨气,正确;②乙烯使溴水褪色,不能证明是发生了加成反应,错误;③白磷的温度高,红磷的温度低,但白磷燃烧,红磷不燃烧,不能比较二者的着火点,二者交换位置可以,错误;④碳化钙遇水即成粉末状,所以不能用简易启普发生器装置来控制反应的进行,错误,所以答案选A。
本题难度:一般
3、实验题 (7分)(1)可以验证镁、铝的金属性强弱的实验是___________。
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(2)现有MgCl2溶液、AlCl3溶液、NaOH溶液、氨水、盐酸等几种物质,试设计实验方案证明镁、铝的金属性强弱。
参考答案:(1)bc
(2)分别取适量MgCl2溶液、AlCl3溶液于两支试管中,分别向两支试管中加入氨水,将所得沉淀等分为两份,分别向一份Mg(OH)2、Al(OH)3中加入适量NaOH溶液,不溶解的是Mg(OH)2,溶解的是Al(OH)3;再分别向另一份Mg(OH)2、Al(OH)3中加入适量盐酸,全部溶解,说明Mg的金属性比Al强。
本题解析:(1)判断金属性强弱,可根据金属与酸或水反应快慢,对应氢氧化物碱性强弱来判断。对于镁、铝可从与热水是否反应及与酸反应快慢来判断。
(2)由题给信息可知,应根据氢氧化铝的两性来判断。
本题难度:简单
4、填空题 (12分)〔Ⅰ〕某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S等物质,设计了以下实验流程图:
请回答以下问题:
(1)为验证气体A,按右图所示装置进行实验:若能观察到酸性高锰酸钾溶液褪色,即可证明火柴头上含有S元素,请写出气体A使酸性高锰酸钾溶液褪色的离子方程式?。
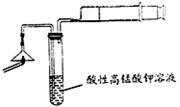
(2)步骤②的实验操作装置如右图所示,该操作的名称是?,其优点是?;
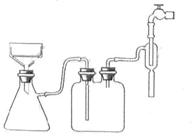
(3)指出图中的错误:
错误①?。
错误②?。
错误③?。
(有几个错误写几个,不一定要填满)
〔Ⅱ〕以下是牙膏中某些主要成分的检验的实验流程图
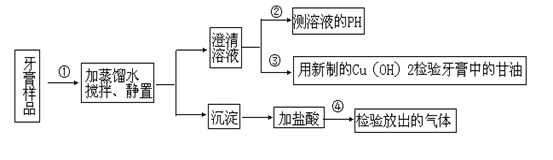
(1)关于上述实验说法不正确的是:
A.在①中,可用倾析法分离溶液和沉淀;
B.在②中,测得PH﹥7,可能是牙膏成分中NaF水解引起的;
C.在③中,用新制Cu(OH)2检验会出现绛蓝色沉淀;
D.在④中,放出的气体通过澄清石灰水不一定出现沉淀;