微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在下列溶液中,各组离子一定能够大量共存的是
A.含c(Fe2+)=1?mol?L-1的溶液:H+、Na+、Cl-、NO3-
B.滴入酚酞显红色的溶液:Na+、Al3+、SO42-、Cl-
C.由水电离出c(OH-)=1×10-12mol?L-1的溶液:K+、HCO、Na+、Cl-
D.滴入KSCN溶液后显红色的溶液:Na+、Cu2+、Br-、SO42-
参考答案:D
本题解析:分析:A.离子之间发生氧化还原反应;
B.滴入酚酞显红色的溶液,显碱性;
C.由水电离出c(OH-)=1×10-12mol?L-1的溶液,为酸或碱溶液;
D.滴入KSCN溶液后显红色的溶液,含铁离子.
解答:A.H+、Fe2+、NO3-离子之间发生氧化还原反应,不能大量共存,故A错误;
B.滴入酚酞显红色的溶液,显碱性,不能存在Al3+,故B错误;
C.由水电离出c(OH-)=1×10-12mol?L-1的溶液,为酸或碱溶液,HCO3-既能与酸反应又能与碱反应,不能共存,故C错误;
D.滴入KSCN溶液后显红色的溶液,含铁离子,该组离子之间不反应,能共存,故D正确;
故选D.
点评:本题考查离子的共存,明确习题中的信息是解答的关键,注意氧化还原及相互促进水解为解答的难点,题目难度中等.
本题难度:困难
2、选择题 下列变化中,不需要破坏化学键的是( )
A.氯化氢溶于水
B.浓硝酸见光分解
C.冰雪融化
D.氯化钠熔化
参考答案:A.氯化氢溶于水时H-Cl共价键被破坏,故A不选;
B.浓硝酸见光分解发生化学反应,所以化学键一定被破坏,故B不选;
C.冰雪融化需克服分子间作用力,而化学键没有变化,故C选;
D.氯化钠熔化时破坏离子键,故D不选;
故选C.
本题解析:
本题难度:简单
3、选择题 下列关于微粒结构的描述正确的是
A.CS2为V形的极性分子
B.ClO3—的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对
D.SiF4和SO 32—的中心原子均为sp3杂化
参考答案:CD
本题解析:A不正确,CS2是直线型分子,属于非极性分子。ClO3—中心原子氯原子含有(7+1-2×3)/2=1,所以是三角锥形,B不正确。选项CD正确,所以答案选CD。
本题难度:一般
4、选择题 下列说法中正确的是
A.分子中键能越大,键长越长,则分子越稳定
B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间可能形成共价键
C.PCl5分子中P原子和Cl原子最外层都满足8电子结构
D.H—O键键能为463 kJ/mol,即18 g H2O分解成H2和O2时,消耗能量为2×463 kJ
参考答案:B
本题解析:分子中键能越大,键长越短,则分子越稳定,A不正确。根据电负性可知碘和锂可能形成共价键,B正确。C不正确,PCl5分子中P原子最外层是10电子结构.。D不正确,由于在形成氢气和氧气是会放出热量,18 g H2O分解成H2和O2时,消耗能量小于2×463 kJ。答案选B。
本题难度:一般
5、选择题 某反应过程中体系的能量变化如图所示,下列说法错误的是

A.反应过程可表示为
B.E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能
C.正反应的热效应为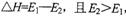 ,所以正反应为放热反应
,所以正反应为放热反应
D.此图中逆反应的热效应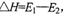 ,为吸热反应
,为吸热反应