微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 工业合成氨反应:N2+3H2

?2NH3,在一定条件下已达到平衡状态.
(1)若降低温度,会使上述平衡向生成氨的方向移动,生成每摩尔氨的反应热数值是46.2KJ/mol,则该反应的热化学方程式为______.
(2)若在恒温条件下,将N2与H2按一定比例混合的气体通入一个容积为2升固定容积的密闭容器中,5分钟后反应达平衡时,n(N2)=1.2mol,n(H2)=1.2mol,n?(NH3)=0.8mol,则反应速率V(N2)=______mol?L-1?min-1,H2的转化率=______,平衡常数=______.若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡______(填向左﹑向右或不移动)移动.
(3)若在恒温恒压条件下,将1molN2与3molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a?molNH3,这时N2的物质的量为______mol,(用含a的代数式表示);若开始时只通入N2与H2,达平衡时生成3amolNH3,则开始时应通入N23mol,H2=______mol(平衡时NH3?的质量分数与前者相同);若开始时通入x?molN2﹑6molH2?和2mol?NH3,达平衡后,N2和NH3的物质的量分别为y?mol和3a?mol,则x=______mol,y=______mol(用含a的代数式表示)
参考答案:(1)因降低温度,平衡向生成氨的方向移动,则正反应为放热反应,生成2molNH3的△H=-46.2KJ/mol×2=-92.4KJ/mol,则热化学方程式为N2(g)+3H2(g)

?2NH3(g)△H=-92.4KJ/mol,
故答案为:N2(g)+3H2(g)

?2NH3(g)△H=-92.4KJ/mol;
(2)5分钟后反应达平衡时,n(N2)=1.2mol,n(H2)=1.2mol,n?(NH3)=0.8mol,
设参加反应的氮气的物质的量为x,则参加反应的氢气的物质的量为3x,则
N2+3H2

?2NH3,
1? 3? 2
x? 3x? 0.8mol
1x=20.8mol,x=0.4mol,
反应速率V(N2)=0.4mol2L5min=0.04mol/L.mim,
氢气的转化率为3×0.4mol3×0.4mol+1.2mol×100%=50%,
平衡时的浓度分别为c(N2)=0.6mol/L、c(H2)=0.6mol/L,c?(NH3)=0.4mol/L,
则平衡常数K=(0.4mol/L)20.6mol/L×(0.6mol/L)3=1.23(mol/L)-2,
上述平衡体系中的混合气体的浓度增大1倍,相当于缩小体积,则压强增大,化学平衡正向移动,即向右移动,
故答案为:0.04;50%;1.23(mol/L)-2;向右;
(3)设生成amolmolNH3转化的N2的物质的量为y,则
N2+3H2

?2NH3,
1? ? 2
x? amol
1x=2amol,x=a2mol,
则平衡时氮气的物质的量为1mol-a2mol=2-a2mol,
又在恒温恒压条件1molN2与3molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a?molNH3,
则只通入N2与H2,达平衡时生成3amolNH3,则开始时应通入N23mol,且平衡时NH3?的质量分数与前者相同,
及极限转化后起始的量与原起始量成正比,故H2的物质的量为3mol×3=9mol,
若开始时通入x?molN2﹑6molH2和2molNH3,将2molNH3极限转化为反应物,则相当于开始加入(x+1)molN2﹑(6+3)molH2,
达平衡后,NH3的物质的量3amol,
则(x+1)mol:(6+3)mol=1:3,解得x=2mol,
由恒温恒压条件,两种情况中起始的反应物的物质的量成正比,则平衡时各物质的含量成正比,
则1molN2与3molH2的混合气体通入发生反应时平衡时氮气的物质的量为2-a2mol,
故开始时通入2molN2﹑6molH2和2molNH3的混合气体通入发生反应时平衡时氮气的物质的量为2-a2mol×3=6-3a2mol,
故答案为:2-a2;9;2;6-3a2.
本题解析:
本题难度:一般
2、计算题 (6分)已知下列两个热化学方程式:
2H2(g)+O2(g)=2H2O(l); ΔH=-571.6kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l); ΔH=-2220kJ/mol
实验测得氢气和丙烷的混合气体共5mol,完全燃烧时放出热量3847kJ,则混合气体中氢气和丙烷的体积比为多少?
参考答案:3 :1
本题解析:混合气体的物质的量为5 mol。设混合气体中氢气的物质的量为x ,丙烷的物质的量为y。
285.8 x + 2220 y = 3847
x + y = 5
解出x = 3.75 y = 1.25
x:y = 3 :1
考点:反应热的计算
点评:此题不难,考查混合物的计算,利用氢气和丙烷的燃烧热可计算出。
本题难度:一般
3、填空题 醋酸是中学常用的一种弱酸。
(1)取0.10mol CH3COOH作导电性实验,测得其导电率随加入的水量变化如图所示:
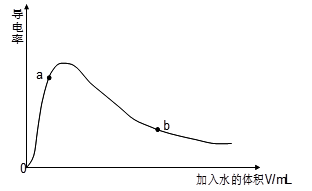
①开始时导电率为0说明: 。
② 比较a、b点的相关性质(填“>”、“<”、“=”):n(H+):a b;c(CH3COO-):a b;完全中和时消耗NaOH的物质的量:a b;
③若b点时,溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为 mol/L;计算b点时醋酸的电离平衡常数,写出计算过程 。
(2)已知:H+(aq) + OH-(aq) = H2O(l) △H1="-57.3" kJ/mol
CH3COOH(aq)  H+(aq) +CH3COO-(aq) △H2="+1.3" kJ/mol
H+(aq) +CH3COO-(aq) △H2="+1.3" kJ/mol
写出稀醋酸与稀烧碱溶液反应的热化学方程式: 。
(3)室温下,取浓度均为0.10mol/L的醋酸与醋酸钠溶液等体积混合后,测得其pH<6,写出混合溶液中的物料守恒关系式 ;并列出其中的离子浓度大小顺序(由大到小) 。
参考答案:(1)①醋酸为共价化合物,只在水溶液中才能电离(2分);
②<;>;=(3分,各1分);
③1.3×10-3 (1分); 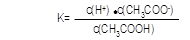 ="(" 1.3×10-3)2/0.10 mol/L=1.7×10-5 mol/L
="(" 1.3×10-3)2/0.10 mol/L=1.7×10-5 mol/L
(2)CH3COOH(aq)+ OH-(aq) = H2O(l) +CH3COO-(aq) △H=-56.0kJ/mol (3分)
(3)c(CH3COOH)+c(CH3COO-)=2c(Na+)或c(CH3COOH)+c(CH3COO-)=0.1mol/L;
c(CH3COO-)>c(Na+)>c(H+)>c(OH-) (4分;各2分)
本题解析:(1)①醋酸是共价化合物,液态醋酸中不存在自由移动的离子;
②对于弱电解质溶液而言,溶液越稀越易电离,所以b点醋酸的电离程度大于a点,H+的物质的量b点大于a点;尽管氢离子物质的量在增大,但增大的幅度不如溶液体积增大的多,所以离子浓度减小,因此b点醋酸根离子浓度小于a点;无论a还是b点,醋酸的物质的量不变,所以需要氢氧化钠的物质的量相等;
③醋酸电离产生等浓度的CH3COO-和H+,所以此时c(CH3COO-)约为1.3×10-3 mol/L;b点的平衡常数K= c(CH3COO-)·c(H+)/ c(CH3COOH)=( 1.3×10-3 mol/L)2/0.10mol/L=1.7×10-5 mol/L;
(2)将已知2个热化学方程式相加得:CH3COOH(aq)+ OH-(aq) = H2O(l) +CH3COO-(aq) △H=-56.0kJ/mol 即为稀醋酸与稀烧碱溶液反应的热化学方程式;
(3)醋酸电离使溶液呈酸性,醋酸钠水解使溶液呈碱性,浓度均为0.10mol/L的醋酸与醋酸钠溶液等体积混合后,测得其pH<6,说明醋酸的电离程度大于醋酸钠的水解程度。则混合液中的物料守恒有:醋酸和醋酸根离子的浓度和是钠离子浓度的2倍,c(CH3COOH)+c(CH3COO-)=2c(Na+);或者混合液中醋酸和醋酸根离子的浓度和是0.10mol/L,c(CH3COOH)+c(CH3COO-)=0.1mol/L;根据以上分析,醋酸的电离程度大于醋酸钠的水解程度,所以混合液中离子浓度最大的是醋酸根离子,其次是钠离子,再次是氢离子,最小是氢氧根离子,c(CH3COO-)>c(Na+)c(H+)>c(OH-)。
考点:考查弱电解质溶液的离子浓度、电离平衡的判断,热化学方程式的书写,混合液的物料守恒及离子浓度大小的比较
本题难度:困难
4、填空题 请按要求完成下列问题:
(1)已知葡萄糖的燃烧热是2804kJ/mol,请写出葡萄糖燃烧的热化学方程式:______,当它氧化生成1g?H2O(l)时放出的热量是:______;
(2)向1mol?L-1纯碱溶液中滴入酚酞溶液,观察到的现象是______,原因是(用离子方程式表示)______.
参考答案:(1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,葡萄糖的燃烧热是2804kJ/mol,说明1mol葡萄糖完全燃烧生成二氧化碳气体和液态水放出2804kJ的热量,
则反应的热化学方程式为C6H12O6(g)+6O2(g)=6CO2(g)+6H2O(l);△H=-2804KJ/mol,
1g?H2O(l)的物质的量为118mol,则当它氧化生成1g?H2O(l)时放出的热量是118mol×16×2804KJ/mol=26kJ,
故答案为:C6H12O6(g)+6O2(g)=6CO2(g)+6H2O(l);△H=-2804KJ/mol;26kJ;
(2)纯碱为强碱弱酸盐,CO32-水解呈碱性,水解离子方程式为CO32-+H2O
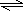
=HCO3-+OH-,加入酚酞溶液变红色,
故答案为:溶液变红;CO32-+H2O
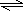
=HCO3-+OH-.
本题解析:
本题难度:一般
5、填空题 写出下列热化学方程式:
(1)2mol Cu(s)与适量O2(g)反应生成CuO(s),放出 314 kJ热量____________;
(2)1mol N2(g)与适量O2(g)反应生成NO(g),需吸收 68 kJ的热量______________;
(3)标准状况下,12 g炭粉在氧气中不完全燃烧生成一氧化碳,放出110. 35 kJ的热量________________。
参考答案:(1) 2Cu (s) +O2 (g) =2CuO(s) △H = - 314kJ·mol-1
(2) N2 (g) +O2 ( g) =2NO( g) △H = +68kJ·mol-1
(3) 2C(s) +O2(g)=2CO(g) △H=-220.7kJ·mol-1
本题解析:
本题难度:一般