微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 工业生产纯碱的工艺流程示意图如下:

完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。 A_______,B_________。
(2)实验室提纯粗盐的实验操作依次为:取样、____ 、沉淀、____、____、冷却结晶、____ 、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是_____________。碳酸化时没有析出碳酸钠晶体,其原因是______________。
(4)碳酸化后过滤,滤液D最主要的成分是____(填写化学式),检验这一成分的阴离子的具体方法是:_____________________。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为:______________________, 滤液D加石灰水前先要加热,原因是______________________。
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:_________ (注明你的表达式中所用的有关符号的含义)。
参考答案:(1)Ca(OH)2或CaO;Na2CO3
(2)溶解;过滤;蒸发;过滤
(3)有晶体析出(或出现浑浊);碳酸钠溶解度比碳酸氢钠大
(4)NH4Cl;取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子
(5)NH4++OH-→ NH3↑ +H2O;防止加石灰水时产生碳酸钙沉淀
(6)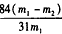 (m1为开始时取用样品质量,m2为加热后残余固体质量)
(m1为开始时取用样品质量,m2为加热后残余固体质量)
本题解析:
本题难度:一般
2、简答题 工业以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为:NH3+CO2+H2O=NH4HCO3;?
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是______(填字母标号).
a.碳酸氢钠难溶于水?b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
d.碳酸氢钠的稳定性大于碳酸钠
(2)某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验.
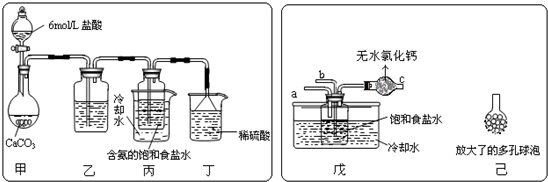
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是______,其作用是______;
(Ⅱ)丁装置中稀硫酸的作用是______;
(Ⅲ)实验结束后,分离出NaHCO3?晶体的操作是______(填分离操作的名称),该操作所需要的玻璃仪器有______.
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从a管通入______气体,说明原因______.
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是______.
(3)碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为______.
(4)请你再设计出一种实验室制取少量碳酸氢钠的方法:______.
参考答案:(1)a、碳酸氢钠易溶于水;故a不符合;
b、碳酸氢钠的受热分解与该现象无关,故b不符合;
c、碳酸氢钠的稳定性不如碳酸钠;由于对于氯化铵来说碳酸氢钠的溶解度更小一些,所以应首先析出;
d、碳酸氢钠的稳定性小于碳酸钠,故d不符合;
故答案为:c.
(2)①(I)利用盐酸制取二氧化碳时二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应,所以通过饱和碳酸氢钠的溶液是为了除掉气体中的氯化氢气体,
故答案为:饱和碳酸氢钠的溶液;除去CO2中的HCl气体;
(II)实验过程中氨气可能有剩余,而稀硫酸能与氨气反应,所以稀硫酸的作用是吸收末反应的NH3,故答案为:吸收未反应完的NH3;
(III)分离出NaHCO3晶体的操作是分离固体与液体,常采用的实验操作是过滤操作;该操作所需要的玻璃仪器为:玻璃棒、漏斗、烧杯,故答案为:过滤;玻璃棒、漏斗、烧杯;
②(I)制取碳酸氢钠时先要得到含氨的饱和食盐水,所以应先通入氨气,而氨气极易溶于水,所以a端通入,从而保证了从b通入二氧化碳时保证了二氧化碳的充分反应;氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵,
故答案为:氨气;氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵;
(II)装置改动后反应物的二氧化碳与溶液的接触面积变大,提高了二氧化碳的吸收率,
故答案为:增大气体与溶液接触面积,提高CO2的吸收率;
(3)碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数可以依据化学方程式进行计算得到;
发生的反应为:2NaHCO3=Na2CO3+CO2↑+H2O,
NaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOH;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;反应生成的碳酸钙物质的量=12g100g/mol=0.12mol;
设加热后的固体12,28g中含碳酸钠物质的量x,碳酸氢钠物质的量为y,依据题意得到:
x+y=0.12
106x+84y=12.28
得到x=0.1mol;y=0.02mol;
则所得固体中碳酸钠的质量分数=0.1mol×106g/mol12.28g×100%=86.3%,
故答案为:86.3%;
(4)从题干信息NH4HCO3+NaCl═NaHCO3↓+NH4Cl;可得制取碳酸氢钠的方法,同时也可采用烧碱溶液中通入过量CO2;往饱和Na2CO3 溶液中通入过量CO2 等得到碳酸氢钠;
故答案为:用碳酸氢铵与适量饱和食盐水反应(或往烧碱溶液中通入过量CO2;往饱和Na2CO3溶液中通入过量CO2等).
本题解析:
本题难度:一般
3、简答题 已知NaHCO3低温时溶解度小,侯德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱.此过程可以表示为:
①NaCl?(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl(此反应是放热反应)
②2NaHCO3
Na2CO3+CO2↑+H2O
现某化学小组根据上述原理在实验室中模拟制碱过程,下图C装置是溶有氨和NaCl的溶液,且二者均达到了饱和.
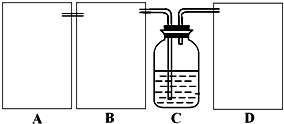
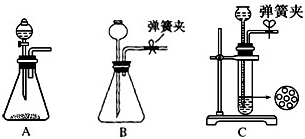
(1)制CO2时为了使反应随开随用,随关随停,上图A方框内应选用以下______装置.简述该装置随关随停的理由______.
(2)为使实验能够进行,在B、D方框内补上所需装置,并指明所用试剂(将装置图画在答题纸上)
(3)完成第(2)步,该小组检验气密性合格后进行实验,发现析出的晶体非常少,在老师的指导下,他们对某个装置进行了改进,达到了实验目的.你认为他们的改进方法是______.
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.46g,假设第二步分解时没有损失,则Na2CO3的产率为______.
参考答案:(1)启普发生器是随时进行,随时停止的装置,适用于固体和液体不加热反应生成不溶于水的气体制备反应,所以制CO2时为了使反应随开随用,随关随停应符合启普发生器的原理应用,利用止水夹控制气体压强,使液体和固体分离停止反应,打开压强减小液体和固体接触继续反应;
故答案为:C,关闭弹簧夹后反应生成的气体上部压强增大,到达一定程度后可把反应液压回漏斗,使固液分离从而停止反应;
(2)制备装置中C为氨化的饱和氯化钠溶液,制备出二氧化碳气体中含有氯化氢气体,影响碳酸氢钠的生成,B装置中需要通过饱和碳酸氢钠溶液除去;D装置是防止氨气污染环境,需要吸收氨气的试剂,可以是稀硫酸或水;B装置洗气装置,导气管长进短出;D装置是吸收易溶于水的氨气,同时防倒吸的装置;装置为
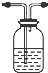
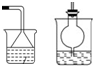
故答案为:试剂:饱和的碳酸氢钠溶液?试剂:稀硫酸或水

?

(3)通过降低温度,减小碳酸氢钠的溶解度,使碳酸氢钠析出,所以将C装置浸泡在一个盛有冰水混合物的水槽里(大烧杯)可以达到目的;
故答案为:将C装置浸泡在一个盛有冰水混合物的水槽里(大烧杯)
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,理论上依据化学方程式计算:NH3+CO2+H2O+NaCl=NaHCO3+NH4Cl;得到碳酸氢钠质量为8.4g,分解生成碳酸钠质量依据化学方程式计算:2NaHCO3=Na2CO3+H2O+CO2↑;碳酸钠的质量为5.5g;实验后得到干燥的NaHCO3晶体的质量为5.46g,生成碳酸钠质量为:
2NaHCO3=Na2CO3+H2O+CO2↑;
168? 106
5.46g? 3.445g
假设第二步分解时没有损失,则碳酸钠的产率=3.445g5.3g×100%=65%;
故答案为:65%
本题解析:
本题难度:一般
4、填空题 纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制 碱法”两种工艺。请按要求回答问题:
?(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:_______________________________________________________;
(2)写出“联合制碱法”有关反应的化学方程式:____________________________________________;
(3) CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?__________________________________________________________;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:
原子利用率(%) =________________________________。
参考答案:
(1)2NH4Cl+Ca( OH)2===2NH3↑+CaCl2+ 2H2O?
(2)NH3+CO2 +H2O +NaCl(饱和)=== NaHCO3↓+NH4Cl? 2NaHCO3===Na2CO3 +CO2↑+H2O (或写总反应方程式:2NaCl+2NH3 +CO2 +H2O===Na2CO3+ 2NH4C1)
(3)“氨碱法”中的CO2来源于石灰石煅烧,“联合制碱法”中的CO2来源于合成氨工业的废气;
(4)“联合制碱法”原子利用率的表达式:

本题解析:
本题难度:一般
5、简答题 某校学生在实验室中设计了如下装置,模拟侯德榜制碱法,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,再将碳酸氢钠晶体加热分解而制得碳酸钠晶体,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
(1)A装置的名称是:______.C装置中稀硫酸的作用为:______,使用球形干燥管的目的是:______.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
NaHCO3
6.9
8.1
9.6
11.1
12.7
14.5
NH4Cl
29.4
33.3
37.2
41.4
45.8
50.4
|
参照表中数据,请分析B装置中使用冰水是因为______.
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在______装置之间(填写字母)连接一个盛有______的洗气装置,其作用是______.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为______.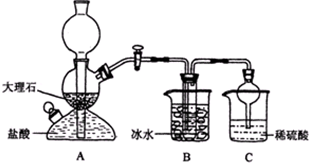
参考答案:(1)依据装置图分析,A为启普发生器,用来制取固体和液体不需要加热,生成的气体难溶于水的气体制备反应,依据侯德榜制碱法,可知生成二氧化碳;其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和;C装置中的稀硫酸时吸收挥发出的氨气,避免污染空气;因为氨气极易溶于水,球形干燥管的组装是为了防止倒吸,
故答案为:启普发生器;吸收从B装置中的试管内逸出的氨气,减少污染;防止倒吸;
(2)图表中物质溶解度比较可知,温度越低,碳酸氢钠的溶解度越小,便于析出,符合制备要求,故答案为:温度越低,碳酸氢钠的溶解度越小,便于析出;
(3)检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,说明生成的二氧化碳气体中含有氯化氢,和氨气反应后,溶液中不易生成碳酸氢钠;需要在A和B之间利用饱和碳酸氢钠溶液除去氯化氢,然后通入氨化的饱和食盐水中,反应析出碳酸氢钠晶体,故答案为:A与B;饱和NaHCO3溶液;除去CO2中混合的HCl气体;
(4)所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,依据化学反应:NaCl+H2O+NH3+CO2=NaHCO3↓+NH4Cl;5.85gNaCl全部反应生成NaHCO3质量为8.4g,实际生成5.04g,所以NaHCO3的产率=实际量理论量×100%=5.04g8.4g×100%=60%,
故答案为:60%.
本题解析:
本题难度:一般