微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)实验室制取SO2的反应原理为:Na2SO3+H2SO4(较浓)====Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率。
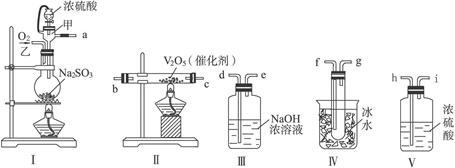
(1)这些装置的连接顺序(按气体左右的方向)是_________→_________→_________→
_________→_________→_________→_________→(填各接口的编号)。
(2)实验时甲仪器的作用与原理是
_________________________________________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是____________。
(4)Ⅳ处观察到的现象是_____________________________________________。
(5)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为___________。
2、选择题 除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法不能达到实验目的的是(?)
?
| 混合物
| 试剂
| 分离方法
|
A
| 苯(苯酚)
| 氢氧化钠溶液
| 分液
|
B
| 甲烷(乙烯)
| 酸性高锰酸钾溶液
| 洗气
|
C
| 乙酸乙酯(乙酸)
| 氢氧化钠溶液
| 蒸馏
|
D
| ?乙炔(硫化氢)
| 硫酸铜
| 洗气
3、实验题 硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4·5H2O),其中一种流程如下:
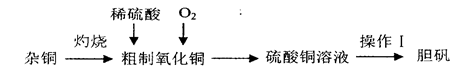
(1)操作I具体为__________、___________、过滤、烘干。
(2)杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是___________(填字母代号)。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分.铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)若将杂铜换为纯净的铜粉,可直接向其中加入稀硫酸和Fe2(SO4)3溶液,不断通入氧气。反应完全后向其中加入过量_______________(填化学式,下同),调节pH至4,生成_________沉淀,过滤得硫酸铜溶液[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4]。
(4)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O)。

烧瓶内发生反应的离子方程式为____________________________________________;
图2是图1的改进装置,其优点有①__________________________,②_________________________。
4、实验题 下图是一套制取并验证氯气部分化学性质的实验装置。

回答下列问题:反应的方程式:MnO2+4HCl(浓) MnCl2+2H2O+ Cl2↑ MnCl2+2H2O+ Cl2↑
(1)装置A中,仪器a盛有的试剂为__?__。
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值____7(填“>”“<”或“=”),写出Cl2与水反应的方程式?
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为_?___色。
(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么?
____?________。
(5)装置E的作用是_____?___。并写出该反应的化学方程式:?。
(6)写出氯气与石灰乳制取漂白粉的化学方程式: ______?______;
5、计算题 实验室要用4 mol·L-1的浓硫酸配制500 mL 0.2 mol·L-1的稀H2SO4溶液。
(1).实验中所需用到的主要玻璃仪器有:量筒、烧杯、玻璃棒、??、 ?等。
(2).需用浓度为4mol/L的浓硫酸的体积为多少mL?
(3).取20 mL该稀溶液,然后加入足量的锌粒,求生成的气体体积(标况下)。
|