微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 利用图所示装置收集以下6种气体(图中烧瓶的位置不得变化)。 ①H2②Cl2 ③CH4 ④HCl ⑤NH3⑥SO2 若烧瓶是干燥的,则由A口进气,可收集的气体有(写序号); ____? ;
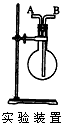
参考答案:①③⑤
本题解析:
本题难度:一般
2、选择题 在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管。下列对其作用的叙述中正确的是(? )

A.防止氯气造成大气污染
B.使反应的氯气循环使用
C.使烧瓶内的压强与大气压保持一致
D.使分液漏斗中的液体更容易注入烧瓶
参考答案:D
本题解析:橡胶管连接的是烧瓶内体系与分液漏斗溶液以上体系,所以保证了这两个体系的压强相同,从而使分液漏斗中的液体更容易流入烧瓶。
本题难度:简单
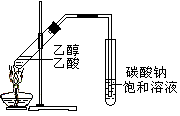
3、选择题 下列实验方案合理的是(?)?
A.向溴乙烷中滴加硝酸银溶液和稀硝酸时,有淡黄色沉淀产生
B.配制Cu(OH)2悬浊液:在一定量CuSO4溶液中,加入少量NaOH溶液
C.制备乙酸乙酯:用右图所示的实验装置
D.鉴别环己烯和苯:将溴的四氯化碳溶液分别滴加到少量环己烯和苯中
参考答案:D
本题解析:溴乙烷和硝酸银溶液不反应,A不正确;B不正确,应该是在一定量NaOH溶液中,加入少量CuSO4溶液;C不正确,导管口不能插入溶液中,以防止倒吸。D中环己烯能和溴的四氯化碳溶液发生加成反应,苯和溴的四氯化碳溶液发生萃取,可以鉴别,选项D正确,答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型。试题贴近高考,综合性强,在注重对学生基础知识巩固与训练的同时,侧重对学生能力的培养与解题方法的指导和训练。有利于调动学生的学习兴趣,激发学生的学习积极性。
本题难度:简单
4、实验题 加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。
【问题1】工业生产碘酸钾的流程如下:?

(1)已知步骤①反应器发生的反应中,生成的两种还原产物所得电子数相同。请写出反应器中发生反应的化学方程式: ? 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是 ? 。
温度/℃
| 20
| 40
| 60
| 80
|
KIO3g/100g水
| 8.08
| 12.6
| 18.3
| 24.8
|
【问题2】已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;? I2+2S2O32-=2I-+S4O62-。
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有? ?。
(2)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL
恰好反应完全。则加碘食盐样品中的碘元素含量是?mg/kg(以含w的代数式表示)。
(3)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
操作步骤
| 实验现象
|
取1g纯净的NaCl,加3mL水配成溶液。
| 溶液无变化
|
滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡。
| 溶液无变化
|
然后再滴入1滴1mol/L的H2SO4,振荡。
| 溶液变蓝色
|
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示?。
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价:?。
参考答案:【问题1】(1)6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑。
(2)蒸发结晶。
【问题2】(1)液体分层,下层液体呈现紫红色。
(2)1270/3W? (423.33/W)。
(3)①4I-+4H++O2=2I2+2H2O。②学生乙实验结果会偏大
本题解析:略
本题难度:简单
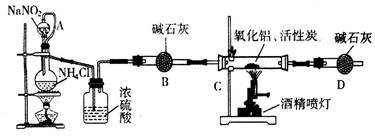
5、实验题 氮化铝(AIN)是一种新型无机材料,广泛应用于集成电路生产领域。某化学研究小组利用氮气、氧化铝和活性炭制取氮化铝,设计下图实验装置。
试回答:
(1)实验中用饱和NaNO2与 NH4C溶液制取氮气的化学方程式为?。
(2)装置中分液漏斗与蒸馏烧瓶之间的导管A的作用是?(填写序号)。
a.防止NaNO2饱和溶液蒸发? b.保证实验装置不漏气? c.使NaNO2饱和溶液容易滴下
(3)按图连接好实验装置,检查装置气密性的方法是?。
(4)化学研究小组的装置存在严重问题,请说明改进的办法?。
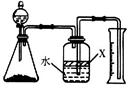
(5)反应结束后,某同学用下图装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计)。已知:氮化铝和NaOH溶液反应生成Na[Al(OH)4]和氨气
 。
。
①广口瓶中的试剂X最好选用?(填写序号)。
a.汽油? b.酒精? c.植物油? d.CCl4
②广口瓶中的液体没有装满(上方留有空间),则实验测得NH3的体积将?(填“偏大”、“偏小”、“不变”)。
③若实验中称取氮化铝样品的质量为10.0g,测得氨气的体积为3.36L(标准状况),则样品中AlN的质量分数为?。
参考答案:(14分)(1)NaNO2+MH4Cl NaCl+N2↑+2H2O(2分)?(2)c(2分)
NaCl+N2↑+2H2O(2分)?(2)c(2分)
(3)在干燥管D末端连接一导管,将导管插入烧杯中的液面下,用酒精灯微热蒸馏烧瓶,导管口有气泡冒出,撤掉酒精灯一段时间,导管内上升一段水柱,说明气密性良好(其它答案合理即可)(2分)
(4)在干燥管D末端连一尾气处理装置(答案合理即可)(2分)
(5)①c?②不变?③61.5%(每空2分,共6分)
本题解析:(1)饱和NaNO2与 NH4C溶液制取氮气,则根据原子守恒可知,还应该有水和氯化钠生成,因此实验中用饱和NaNO2与 NH4C溶液制取氮气的化学方程式为NaNO2+MH4Cl NaCl+N2↑+2H2O。
NaCl+N2↑+2H2O。
(2)由于蒸馏烧瓶中有气体生成,压强大,分液漏斗中的液体不易滴下。分液漏斗与蒸馏烧瓶之间的导管A连接后,可以保持压强相同,使NaNO2饱和溶液容易滴下,答案选c。
(3)一般常用空气热胀冷缩法,因此根据该实验装置的特点可知,检查装置气密性的方法是在干燥管D末端连接一导管,将导管插入烧杯中的液面下,用酒精灯微热蒸馏烧瓶,导管口有气泡冒出,撤掉酒精灯一段时间,导管内上升一段水柱,说明气密性良好。
(4)由于氮气、氧化铝和活性炭制取氮化铝的同时,还有CO生成,所以必须有尾气处理装置,即在干燥管D末端连一尾气处理装置。
(5)①氮化铝和NaOH溶液反应生成Na[Al(OH)4]和氨气,所以要通过排水法测量氨气的体积,则根据氨气极易溶于水可知,X应该是密度小于水与水不溶的试剂。汽油易挥发,a不正确。酒精和水互溶,四氯化碳密度大于水,因此选项bd均不正确。植物油密度小于水、不溶于水,c正确,答案选c。
②广口瓶中的液体没有装满(上方留有空间),由于排除的水是依据压强差来完成的,所以对实验结果不影响,即则实验测得NH3的体积将不变。
③测得氨气的体积为3.36L(标准状况),氨气的物质的量是3.36L÷22.4L/mol=0.15mol,则根据氮原子守恒可知,氮化铝的物质的量是0.15mol,质量是0.15mol×41g/mol=6.15g,所以品中AlN的质量分数为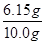 ×100%=61.5%。
×100%=61.5%。
本题难度:困难