微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (1)已知Na2S2O3+H2SO4═NaSO4+S↓+SO2+H2O.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如表(所取溶液体积均为10mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1
①
25
0.1
0.1
②
25
0.2
0.1
③
25
0.1
0.2
④
50
0.2
0.1
⑤
50
0.1
0.1
|
其他条件不变时:探究温度对化学反应速率的影响,应选择实验______(填实验编号);
若同时选择实验①、实验②、实验③,测定混合液变浑浊的时问,可探究______对化学反应速率的影响.
(2)某同学设计如图实验流程探究Na2S2O3的化学性质.
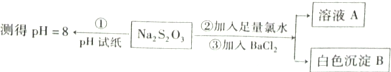
用离子议程式表示Na2S2O3溶液具有碱性的原因______,实验操作①中测试时pH试纸的颜色应该接近______.
A.红色B.深蓝色C.黄色D.绿色
上述流程中实验②、③的目的是为了探究Na2S2O3某种化学性质,你认为是探究了Na2S2O3的______性.
2、选择题 下列各组反应(表中物质均为反应物):刚开始时,放出H2的速率最大的是
[? ]
?
?金属(粉末状)
物质的量(mol)
?酸的浓度
酸的体积
?反应温度
A.?
Mg
?0.1
6mol/LHNO3
?10mL
60℃
B.?
Mg
0.1
3mol/LHCl
10mL
60℃
C.
Fe
0.1
3mol/LHCl
10mL
60℃
D.?
Mg
0.1
?3mol/LHCl
10mL
50℃
3、选择题 将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是( )
A.从t1→t2的原因是镁与酸的反应是放热反应,体系温度升高
B.从t1→t2的原因是镁与水反应,致使酸的浓度升高
C.从t2→t3的原因是随着反应的进行酸的浓度下降
D.从t2→t3的原因是随着反应的进行温度越来越低

4、选择题 设C(s)+CO2(g) 2CO(g);ΔH1>0反应速率为v1;设N2(g)+3H2(g)
2CO(g);ΔH1>0反应速率为v1;设N2(g)+3H2(g) 2NH3(g);ΔH2<0反应速率为v2。
2NH3(g);ΔH2<0反应速率为v2。
对于上述反应,当温度降低时,v1和v2的变化情况为( )
A.同时增大
B.同时减小
C.v1增大,v2减小
D.v1减小,v2增大
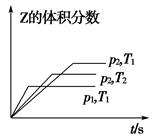
5、选择题 在一密闭容器中发生反应:2X(g)+Y(g) aZ(g) ΔH=Q kJ·mol-1,开始按体积比2∶1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图象,下列有关说法正确的是( )
aZ(g) ΔH=Q kJ·mol-1,开始按体积比2∶1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图象,下列有关说法正确的是( )
 ?
?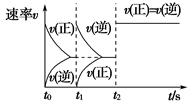
甲 ? 乙
A.图甲,p1>p2,a<3
B.图甲,T1<T2,Q>0
C.图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体
D.图乙,如果a=3,t2时表示向体系中加入了催化剂或增大压强