洗气
参考答案:BC
本题解析:B项:乙烯被酸性高锰酸钾溶液氧化成CO2等物质而引入了新的杂质,故错;C项:乙酸乙酯和氢氧化钠溶液发生反应,故错。故选BC。
点评:本题主要主要考查了物质的除杂,抓住除杂质至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质是解题的关键。
本题难度:简单
3、实验题 硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4·5H2O),其中一种流程如下:
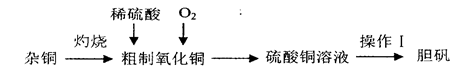
(1)操作I具体为__________、___________、过滤、烘干。
(2)杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是___________(填字母代号)。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分.铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)若将杂铜换为纯净的铜粉,可直接向其中加入稀硫酸和Fe2(SO4)3溶液,不断通入氧气。反应完全后向其中加入过量_______________(填化学式,下同),调节pH至4,生成_________沉淀,过滤得硫酸铜溶液[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4]。
(4)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O)。

烧瓶内发生反应的离子方程式为____________________________________________;
图2是图1的改进装置,其优点有①__________________________,②_________________________。
参考答案:(16分)(1)蒸发浓缩(2分);冷却结晶(2分) (2)ab(2分,选对1个1分,有错误不得分)
(3)CuO(2分,其它合理答案也可) Fe(OH)3(2分)
(4)Cu+4H++2NO3-=Cu2++2H2O+2NO2↑;3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑(2分,写对1个即得2分) ①防止NaOH溶液倒吸进入发生装置(2分) ②NO、NO2有毒气体能被完全吸收(2分)
本题解析:(1)硫酸铜能溶于水,所以从硫酸铜溶液中得到硫酸铜晶体得操作应该是蒸发浓缩、冷却结晶,然后过滤烘干即可。
(2)灼烧后的产物除氧化铜还含少量铜,这说明a.灼烧过程中部分氧化铜被还原,a正确;b.灼烧不充分.铜未被完全氧化,b正确;c.氧化铜稳定,在加热过程中不可能分解生成铜,c不正确;d.铜极易被氧化生成氧化铜,d不正确,答案选ab。
(3)由于反应中不能再引入新的杂质,所以要调节溶液的pH小于进入氧化铜或氢氧化铜。由于氢氧化铁沉淀的pH小于氢氧化铜沉淀的pH,所以首先生成氢氧化铁沉淀,过滤得硫酸铜溶液。
(4)硝酸具有强氧化性,能把铜氧化生成硝酸铜,但随着反应的进行,硝酸浓度逐渐降低,其还原产物将逐渐变为NO,因此有关反应的化学方程式是Cu+4H++2NO3-=Cu2++2H2O+2NO2↑、3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑。由于NO2与氢氧化钠溶液反应时,溶液容易倒吸,且NO与氢氧化钠溶液不反应,易造成环境污染,所以图2中通入氧气可以氧化NO而不完全吸收,即装置2的优点是①防止NaOH溶液倒吸进入发生装置;②NO、NO2有毒气体能被完全吸收。
本题难度:一般
4、实验题 下图是一套制取并验证氯气部分化学性质的实验装置。

回答下列问题:反应的方程式:MnO2+4HCl(浓) MnCl2+2H2O+ Cl2↑ MnCl2+2H2O+ Cl2↑
(1)装置A中,仪器a盛有的试剂为__?__。
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值____7(填“>”“<”或“=”),写出Cl2与水反应的方程式?
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为_?___色。
(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么?
____?________。
(5)装置E的作用是_____?___。并写出该反应的化学方程式:?。
(6)写出氯气与石灰乳制取漂白粉的化学方程式: ______?______;
参考答案:(1)浓盐酸
(2) <?Cl2+H2O≒HCl+HClO
(3)蓝色
(4)能,因为湿润的氯气有漂白性
(5) 吸收多余的氯气? Cl2+2NaOH===NaCl+NaClO+H2O
(6)2Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O
本题解析:考查氯气的制取及性质
(1)反应原理为:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O,故分液漏斗中装的是浓盐酸
(2)由于反应Cl2+H2O≒HCl+HClO生成了酸,故溶液呈酸性,pH<7
(3)由于反应生成碘单质:Cl2+2I-=2Cl-+I2,使淀粉呈蓝色
(4)由于氯气为湿润的,故有次氯酸生成,具有漂白性,干燥的有色布条能褪色.
(5)氯气有毒,一般用碱液吸收:Cl2+2NaOH===NaCl+NaClO+H2O
(6)2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
本题难度:一般
5、计算题 实验室要用4 mol·L-1的浓硫酸配制500 mL 0.2 mol·L-1的稀H2SO4溶液。
(1).实验中所需用到的主要玻璃仪器有:量筒、烧杯、玻璃棒、??、 ?等。
(2).需用浓度为4mol/L的浓硫酸的体积为多少mL?
(3).取20 mL该稀溶液,然后加入足量的锌粒,求生成的气体体积(标况下)。
参考答案:(1)500ml 容量瓶?滴管?(2)0.025L?(3)0.896L
本题解析:(1)用浓硫酸配制500ml稀硫酸,则需要的仪器除量筒、烧杯、玻璃棒外还需要500ml容量瓶和定容时的胶头滴管。
(2)根据C1V1 = C2V2
?则0.5×0.2 =4×V2
?解得 V2=0.025(L)
(3) Zn? +? H2SO4 ?=? ZnSO4?+? H2 ↑
1 mol?22.4L
0.02L×0.2mol/L? VL
解得 V=0.896L
点评:该题是基础性试题的考查,试题注重基础,难易适中,有助于培养学生的规范答题能力,提高学生的逻辑思维能力和灵活应变能力。该题难度不大,学生不难得分。
本题难度:一般
|