微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)二氧化锰是化学工业中常用的氧化剂和有机合成中的催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3+O2 2MnO2+2CO2。经研究发现该反应过程为①MnCO3
2MnO2+2CO2。经研究发现该反应过程为①MnCO3 MnO+CO2 ②2MnO+O2
MnO+CO2 ②2MnO+O2 2MnO2。
2MnO2。
回答下列问题:
(1)某温度下该平衡体系的压强为P,CO2、O2的物质的量分别为n1和n2,用平衡分压代替平衡浓度,写出碳酸锰热分解反应的平衡常数表达式K= (分压=总压×物质的量分数);K与反应①、②的平衡常数K1、K2关系为 。
(2)反应②在低温下能自发进行,则其△H 0(填“>”、“<”、“=”)。
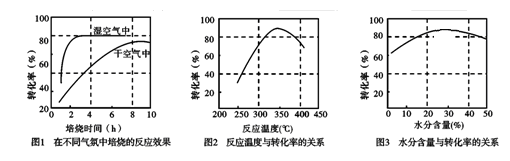
(3)某科研小组对碳酸锰热分解法制二氧化锰的条件(焙烧温度和气氛)进行了研究,获得如下三幅图。该制备反应合适的焙烧温度为 ,合适的含水量气氛条件为 。
(4)MnO2也可在MnSO4—H2SO4—H2O为体系的电解液中电解获得,其阳极的电极反应式为 ,电解后溶液的pH将 (填“增大”、“ 减小”或“不变”)。
参考答案:(1)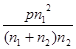 (2分)
(2分) 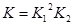 (2分)
(2分)
(2)< (1分) (3)350℃ (1分) 含水量30% (1分)
(4)Mn2+-2e-+2H2O = MnO2+4H+ (2分) 减小(1分)
本题解析:(1)根据题意和题给反应方程式知,碳酸锰热分解反应的平衡常数表达式K=P2(CO2)/P(O2)= 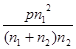 ;K1= P(CO2)、K2=1/P(O2),K与K1、K2关系为
;K1= P(CO2)、K2=1/P(O2),K与K1、K2关系为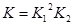 。(2)当△H—T△S<0时反应自发进行,反应②为气体物质的量减少的熵减反应,△S<0,且在低温下能自发进行,则其△H<0。(3)根据图1知,反应在湿空气中进行反应速率快,碳酸锰的转化率高;根据图2知,反应在350℃时碳酸锰的转化率最高,根据图3知,水分含量为30%时碳酸锰的转化率最高,该制备反应合适的焙烧温度为350℃,合适的含水量气氛条件为含水量30% 。(4)电解法制备MnO2阳极发生氧化反应,MnSO4被氧化为MnO2,根据电荷守恒和溶液的酸碱性知,其阳极的电极反应式为Mn2+-2e-+2H2O = MnO2+4H+,阴极发生还原反应,电极反应式为2H++2e-
。(2)当△H—T△S<0时反应自发进行,反应②为气体物质的量减少的熵减反应,△S<0,且在低温下能自发进行,则其△H<0。(3)根据图1知,反应在湿空气中进行反应速率快,碳酸锰的转化率高;根据图2知,反应在350℃时碳酸锰的转化率最高,根据图3知,水分含量为30%时碳酸锰的转化率最高,该制备反应合适的焙烧温度为350℃,合适的含水量气氛条件为含水量30% 。(4)电解法制备MnO2阳极发生氧化反应,MnSO4被氧化为MnO2,根据电荷守恒和溶液的酸碱性知,其阳极的电极反应式为Mn2+-2e-+2H2O = MnO2+4H+,阴极发生还原反应,电极反应式为2H++2e- H2,电解总反应为Mn2+-+2H2O
H2,电解总反应为Mn2+-+2H2O 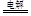 MnO2+ H2+2H+,电解后溶液的pH将减小。
MnO2+ H2+2H+,电解后溶液的pH将减小。
考点:考查化学平衡常数表达式书写,化学反应方向,平 91EXAM.org衡图像分析和电解原理。
本题难度:困难
2、选择题 根据金属活动性顺序表,Cu不能发生:Cu+2H2O==Cu(OH)2+H2↑的反应。但选择恰当的电极材料和电解 质溶液进行电解,这个反应就能实现。下列四组电极和电解液中,能实现该反应最为恰当的一组是
[? ]
阳极
阴极
电解液
A.
石墨棒
石墨棒?
CuSO4溶液?
B.
Cu
石墨棒
Na2SO4溶液
C.
Cu
Fe
H2SO4溶液
D.
Cu
Pt
CuSO4溶液
参考答案:B
本题解析:
本题难度:一般
3、选择题 用Pt电极电解KCl和CuSO4的混合溶液,当电路中通过0.4mol电子的电量时,阴阳两极都产生0.14mol的气体,若电解后溶液体积为40L,则电解后溶液的pH为( )
A.1
B.3
C.7
D.11
参考答案:根据题意可知,当电路中通过0.4mol电子的电量时,阴阳两极都产生0.14mol的气体,阴极产生的气体为H2,阳极产生的气体为Cl2和O2,
生成0.14molH2转移电子为0.14mol×2=0.28mol,所以阴极析出Cu的物质的量=0.4mol-0.28mol2=0.06mol.
令阳极气体中Cl2、O2的物质的量分别为xmol、ymol,根据转移的电子数和产生气体的物质的量,则:
本题解析:
本题难度:简单
4、填空题 )如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8~8.0,酸色—红色,碱色—黄色)
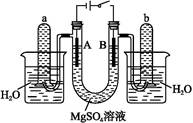
回答下列问题:
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是 (填编号);
①A管溶液由红变黄
②B管溶液由红变黄
③A管溶液不变色
④B管溶液不变色
(2)写出A管中发生的反应: ;
(3)写出B管中发生的反应: ;
(4)检验a管中气体的方法是 ;
(5)检验b管中气体的方法是 ;
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是 。
参考答案:(1)①④
(2)2H++2e- H2↑、Mg2++2OH-
H2↑、Mg2++2OH- Mg(OH)2↓
Mg(OH)2↓
(3)4OH--4e- 2H2O+O2↑
2H2O+O2↑
(4)用拇指按住管口,取出试管,靠近火焰,放开拇指,有爆鸣声,管口有蓝色火焰
(5)用拇指按住管口,取出试管,放开拇指,将带有火星的木条伸入试管内,木条复燃
(6)溶液呈红色,白色沉淀溶解(或大部分溶解)
本题解析:由装置图可知A为电解池的阴极,电极反应为:4H++4e- 2H2↑;B为电解池的阳极,电极反应为:4OH--4e-
2H2↑;B为电解池的阳极,电极反应为:4OH--4e- 2H2O+O2↑。根据放电情况可知A极由于H+放电附近显碱性,指示剂应显黄色,同时还会发生反应Mg2++2OH-
2H2O+O2↑。根据放电情况可知A极由于H+放电附近显碱性,指示剂应显黄色,同时还会发生反应Mg2++2OH- Mg(OH)2↓;B极由于OH-放电附近显酸性,指示剂仍显本身的颜色红色。在检验H2时利用其可燃性,检验O2时利用其能使带火星的木条复燃的性质进行检验。由于该电解池实质是电解水,所以将电解液倒入烧杯后,整个溶液呈中性,故指示剂变红,Mg(OH)2沉淀会消失。
Mg(OH)2↓;B极由于OH-放电附近显酸性,指示剂仍显本身的颜色红色。在检验H2时利用其可燃性,检验O2时利用其能使带火星的木条复燃的性质进行检验。由于该电解池实质是电解水,所以将电解液倒入烧杯后,整个溶液呈中性,故指示剂变红,Mg(OH)2沉淀会消失。
考点:原电池、电解
本题难度:一般
5、选择题 铅蓄电池的工作原理为: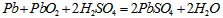 ,如下图,下列判断不正确的是
,如下图,下列判断不正确的是
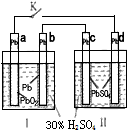
[? ]
A.K 闭合时,d电极反应式: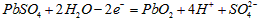
B.当电路中转移0.2mol电子时,I中消耗的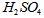 为0.2 mol
为0.2 mol
C.K闭合时,II中SO42-向c电极迁移
D.K闭合一段时间后,II可单独作为原电池,d电极为正极
参考答案:C
本题解析:
本题难度:一般