微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验不能达到目的的是
A.欲除去CO2中混有的SO2,将混合气通入饱和的碳酸钠溶液
B.乙醇中混有乙酸可向混合液中加入过量的NaOH溶液后蒸馏除去乙酸
C.油水混合体系可用分液的方法分离
D.碳酸钠固体中混有NaHCO3,将混合物加热至质量不再发生变化
参考答案:A
本题解析:A不正确,CO2也能和碳酸钠溶液反应,应该用饱和碳酸氢钠溶液;B中氢氧化钠和乙酸反应,然后蒸馏即可得到乙醇,正确;油不溶于水,分液即可,C正确;碳酸氢钠加热以分解,生成碳酸钠、水和CO2,D正确,答案选A。
点评:该题是高考中的常见考点和题型,属于中等难度的试题。侧重对学生实验能力的培养,有利于培养学生规范严谨的实验设计能力。该类试题需要注意的是分离提纯方法的选择思路是根据分离提纯物的性质和状态来定的。具体如下:①分离提纯物是固体(从简单到复杂方法) :加热(灼烧、升华、热分解),溶解,过滤(洗涤沉淀),蒸发,结晶(重结晶);②分离提纯物是液体(从简单到复杂方法) :分液,萃取,蒸馏;③分离提纯物是胶体:盐析或渗析;④分离提纯物是气体:洗气。
本题难度:简单
2、选择题 某同学对下列四个实验都设计了两种方案,其中两种方案均合理的是
选项
| A
| B
| C
| D
|
实验
目的
| 除去碳酸钠中少量的碳酸氢钠
| 清洗铁制品
表面的铁锈
| 检验苯中
含有少量甲苯
| 鉴别二氧化氮
和溴蒸汽
|
方案1
| 溶解后加入盐酸
| 加适量稀盐酸
| 加入Br2/CCl4
| 加水
|
方案2
| 加热
| 用水洗涤
| 加入酸性KMnO4
| 加压
参考答案:D
本题解析:A、除去碳酸钠中少量的碳酸氢钠,方案1溶解后加入盐酸会混入氯离子,盐酸的量也不好控制,方案2加热碳酸氢钠分解生成碳酸钠,合理;B清洗铁制品表面的铁锈,方案1:加适量稀盐酸,铁锈的主要成份是氧化铁,氧化铁与盐酸反应,合理;方案2:用水洗涤,水不能将铁锈洗掉,还会加快铁的锈蚀,不合理.C苯和甲苯都不与溴发生反应,甲苯可以使酸性KMnO4褪色,方案1不合理,反案2合理。D鉴别二氧化氮和溴蒸汽加水溶液为无色的是二氧化氮溶液为红棕色的为溴蒸汽,加压易液化的为溴蒸汽,D均合理。
本题难度:一般
3、选择题 下列实验操作中有错误的是?
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,温度计水银球应浸没在液体中
C.蒸馏中,冷却水应从冷凝管的下口通入,上口流出。
D.用湿润的红色石蕊试纸检验氨气
参考答案:B
本题解析:略
本题难度:简单
4、选择题 下列实验操作中,先后顺序正确的是?(?)
A.在进行中和滴定是,先固定沉定管,后润洗、装液
B.测定硫酸铜晶体的结晶水含量时,先称取一定量的晶体,后放入坩埚
C.为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
D.实验室抽取干燥纯净的氯气时,先使氯气通过饱和食盐水,后通过浓硫酸
参考答案:D
本题解析:略
本题难度:简单
5、推断题 (13分)硫代硫酸钠(Na2S2O3)俗称海波,它可看成是用一个S原子取代了Na2SO4中的一个O原子而形成的。某校化学研究性学习小组用类比学习思想,并通过实验探究Na2S2O3的化学性质。
【提出问题】Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
【实验探究】取适量Na2S2O3晶体,溶于水制成Na2S2O3溶液,进行如表所示的探究,完成表中有关内容。
实验操作
| 实验现象
| 现象解释(用离子方程式表示)
| 探究①A.?
B.向pH=2的硫酸中滴加Na2S2O3溶液
| a.溶液pH=8
b.?
| i.?
ii. S2O32-+2H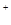 =S↓ +SO2↑ +H2O =S↓ +SO2↑ +H2O
| 探究②C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液
| c.氯水颜色变浅
| iii.?
|
【实验结论】探究①?探究②?。
根据探究①和探究②的结论,Na2S2O3和Na2SO4化学性质?。
【问题讨论】
(1)甲同学向探究②反应后的溶液中滴加AgNO3溶液,出现白色沉淀,据此甲同学认为氯水可将Na2S2O3氧化。你认为此方案是否正确并说明理由:?。
(2)请你重新设计一个实验方案,证明Na2S2O3能被氯水氧化。你设计的方案是?。
参考答案:A.用玻璃棒蘸取Na2S2O3溶液点在pH试纸上,并与标准比色卡对照(1分)
i. S2O32-+H2O HS2O3-+OH-(2分) HS2O3-+OH-(2分)
B. 有淡黄色沉淀(1分),有无色刺液性气味气体产生(1分)
iii. S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+(2分)
探究①:Na2S2O3溶液呈碱性(1分),能与强酸反应(1分)。
探究②:Na2S2O3具有还原性(1分),不相似(1分)。
【问题与讨论】(1)不正确,因为氯水中含有Cl-(1分)。
(2)取少量探究②反应后的溶液,向其中滴入BaCl2溶液,若有白色沉淀,则说明Na2S2O3被氯水氧化。(1分)
本题解析:A.根据实验现象可知,该步操作是测定溶液pH值的,因此正确的操作应该是用玻璃棒蘸取Na2S2O3溶液点在pH试纸上,并与标准比色卡对照。
i.溶液显碱性,说明酸根水解,离子方程式为S2O32-+H2O HS2O3-+OH-。 HS2O3-+OH-。
B.根据反应的生成物有单质硫和 二氧化硫生成可知,实验现象为有淡黄色沉淀,有无色刺液性气味气体产生。
iii.氯水颜色变浅说明发生了氧化还原反应,即硫代硫酸钠被氧化,则反应的离子方程式为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+。
根据实验操作以及实验现象可知探究①是探究Na2S2O3溶液呈碱性,能与强酸反应。探究②是探究Na2S2O3具有还原性。由于硫酸钠不能与强酸反应,也没有还原性,所以二者的性质不相似。
【问题与讨论】(1)因为氯水中含有Cl-也能与硝酸银溶液反应产生白色沉淀,因此结论是不正确的。
(2)由于氧化产物是硫酸钠,因此可以通过验证硫酸根的生成即可,则实验操作为取少量探究②反应后的溶液,向其中滴入BaCl2溶液,若有白色沉淀,则说明Na2S2O3被氯水氧化。
本题难度:一般
|