微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 2009年12月7日~18日在丹麦首都哥本哈根召开了世界气候大会,商讨《京都议定书》一期承诺到期后的后续方案,即2012年至2020年的全球减排协议,大会倡导“节能减排” 和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
 CO2(g)+3H2(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化:
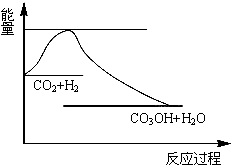
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
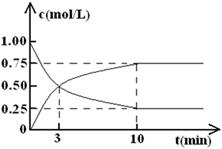
①从反应开始到平衡,CO2的平均反应速率v(CO2)= 。
②该反应的平衡常数表达式K= 。
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和3 molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,写出该反应的热化学方程式:___________________________________________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入或通入的物质有__________ _____;其正极的电极反应式是:_____________________________________。
参考答案:(1) C(2分)
(2) ① 0.075 mol·L-1·min-1(2分,单位错漏扣1分)
② 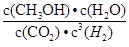 (2分)
(2分)
③ BD(2分,只有填写BD才可得分,其他填法均不能得分)
(3)CH3OH(l)+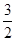 O2 =CO2(g)+2H2O(l) △H=-725.8 kJ·mol-1(3分,单位错漏扣1分)
O2 =CO2(g)+2H2O(l) △H=-725.8 kJ·mol-1(3分,单位错漏扣1分)
(4)甲醇、氢氧化钠、水(漏写一个扣1分,漏写两个或错写均不得分);O2+2H2O+4e-=4OH?(各2分)
本题解析:化学高考试题中的信息题常常和时事联系很紧密。
图像类试题一直在高考试题中保留,并且今后还会继续保留。这类题型能够考查学生对图形图像的抽象、概括和分析能力,对图像数据的处理能力。另处,预计今年电化学、化学平衡常数、反应热和熵变的判断将成为某些地区考题的热点,特别是第一届新课标高考的省区,故笔者在设计试题时安排了上述的内容。
本题集化学反应速率与化学平衡、反应热和电化学知识为一体,通过甲醇联系起来,可谓“一题多点”,这样设计有利于考查学生综合运用所学知识解决实际问题的能力。笔者对近年来的各省区高考试题分析,这样的题型很有可能是今后高考命题的一个方向。本题难度适中,符合2010年高考考试大纲要求。
(1)通过图像可以看出,该反应是一个放热反应,因而△H<0;又由化学方程式CO2(g)+3H2(g) CH3OH(g)+H2O(g)得,反应后气体分子的物质的量减小,故△S<0,所以C项正确;
CH3OH(g)+H2O(g)得,反应后气体分子的物质的量减小,故△S<0,所以C项正确;
(2)①因容器的体积为l L,CO2的起始浓度为1.00 mol/L,平衡浓度为0.25 mol/L,反应时间为10 min,所以CO2的平均反应速率v(CO2)= 0.075 mol·L-1·min-1;
①该反应的平衡常数表达式K= 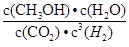 ;
;
③由于该反应的正反应是放热反应,所以升高温度,平衡会逆向移动,A项错误;将CH3OH(g)及时液化抽出,相当于减小生成物的浓度,使平衡正向移动,B项正确;催化剂只能影响反应速率,不能使平衡发生移动,C项错误;再充入l molCO2和3 molH2相当于增大体系的压强,化学平衡向气体体积缩小的方向(即正向)移动,故D项正确。
(3)根据题意, 16g 液态甲醇,即0.5 mol CH3OH完全燃烧,当恢复到原状态时,放出369.2kJ的热量,可以计算出1 mol CH3OH完全燃烧应放出热量725.8 kJ,故该反应的热化学方程式:CH3OH(l)+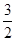 O2(g)=CO2(g)+2H2O(l) △H=-725.8 kJ·mol-1;
O2(g)=CO2(g)+2H2O(l) △H=-725.8 kJ·mol-1;
(4)作为电池的负极应是失去电子的物质,发生的是氧化反应;正极处发生的是还原反应。原料为氢氧化钠、甲醇、水和氧气,显然氧化的氧化性强,是得到电子的物质,甲醇是失去电子的物质,而氢氧化钠、水是电解质溶液。所以在电池的负极应加入或通入的物质有甲醇、氢氧化钠和水。正极为氧气得电子,发生的电极反应式为O2+2H2O+4e-=4OH?。
本题难度:困难
2、选择题 在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是
[? ]
A.CH3OH(l)+3/2O2(g)== CO2(g)+2H2O(l) △H=+725.8 kJ/mol
B.2CH3OH(l)+3O2(g)== 2CO2(g)+4H2O(l) △H=-1452 kJ/mol
C.2CH3OH(l)+3O2(g)== 2CO2(g)+4H2O(l) △H=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g)== 2CO2(g)+4H2O(l) △H=+1452 kJ/mol
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列热化学方程式或离子方程式中,正确的是
[? ]
A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热
19.3kJ,其热化学方程式为: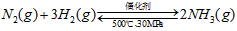 ?△H=-38.6kJ·mol-1
?△H=-38.6kJ·mol-1
C.氯化镁溶液与氨水反应: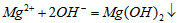
D.氧化铝溶于NaOH溶液:Al2O3 + 2OH- =2AlO2- + H2O
参考答案:D
本题解析:
本题难度:一般
4、选择题 化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是

[? ]
A. N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)=2NH3(g); △H=2(b-a)kJ·mol-1
C. 1/2N2(g)+3/2H2(g)=NH3(1); △H=(h+c-a)kJ·mol-1
D. 1/2N2(g)+3/2H2(g)=NH3(g); △H=(a+b)kJ·mol-1
参考答案:A
本题解析:
本题难度:简单
5、选择题 用CH4催化还原NOX可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
下列说法不正确的是( ? )
A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)△H=-Q,Q>574kJ?mol-1
B.等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同
C.若用标准状况下4.48LCH4还原NO2至N2,放出的热量为173.4kJ
D.若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为1.6mol
参考答案:B
本题解析:
本题难度:简单