微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g)测得开始时,SO2、O2和SO3的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是
2SO3(g)测得开始时,SO2、O2和SO3的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是
[? ]
A.O2为0.15mol·L-1
B.SO2为0.25mol·L-1
C.SO3为0.4mol·L-1
D.O2、SO3的浓度相等
2、选择题 将4 mol A和2 mol B放入2 L密闭容器中发生反应:2A(g)+B(g) 2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是( )
2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是( )
A.4 s内,v(B)=0.075 mol/(L·s)
B.当c(A)∶c(B)∶c(C)=2∶1∶2时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
3、计算题 (12分)氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化。
(1)对反应N2O4(g) 2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1?T2(填“>”、“<”或“=”);A、C两点的速率vA ?vC(同上)。
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1?T2(填“>”、“<”或“=”);A、C两点的速率vA ?vC(同上)。

(2)在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
时间(s)
| 0
| 20
| 40
| 60
| 80
|
n(NO2)/mol
| 0.40
| n1
| 0.26
| n3
| n4
|
n(N2O4)/mol
| 0.00
| 0.05
| n2
| 0.08
| 0.08
|
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为?。
②100℃时,反应2NO2(g) N2O4(g)的平衡常数K的值为?。
N2O4(g)的平衡常数K的值为?。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是?mol/L
④计算③中条件下达到平衡后混合气体的平均相对分子质量为?。(结果保留小数点后一位)
4、选择题 在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g) 2HI(g),已知H2和I2的起始浓度均为0.1 mol·L-1时,达平衡时HI的浓度为0.16 mol/L。若H2和I2的起始浓度均变为0. 2 mol/L,则平衡时H2的浓度是(?)
2HI(g),已知H2和I2的起始浓度均为0.1 mol·L-1时,达平衡时HI的浓度为0.16 mol/L。若H2和I2的起始浓度均变为0. 2 mol/L,则平衡时H2的浓度是(?)
A.0.32 mol/L
B.0.16 mol/L
C.0.08 mol/L
D.0.04 mol/L
5、填空题 (1)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
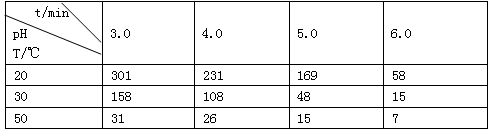
①pH增大能加速O3分解,表明对O3分解起催化作用的是_________________。
②据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填代号)
a. 40°C、pH=3.0? b. 10°C、pH=4.0? c. 30°C、pH=7.0
(2)向一容积为2升的密闭容器中充入2molA、0.6molC和一定量的B三种气体,一定条件下发生某种反应。现有两个图像分别对该反应的情况进行描述:
图1表示各物质的浓度随时间的变化情况,其中t0~t1阶段c(B)未画出;
图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件(其中t2改变的条件是加入某种催化剂);(说明:图1中实线表示反应进程)
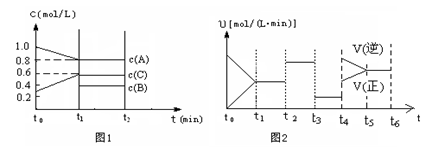
①你认为t3时改变的条件是?(填写“加压”或“减压”),B的起始物质的量为?mol;
②各阶段平衡时对应的平衡常数如下表所示:
时间段
| t1~t2
| t2~t3
| t3~t4
| t5~t6
|
平衡常数
| K1
| K2
| K3
| K4
|
用“﹥、﹤、=”符号来表达K1、K2、K3、K4之间的关系? 写此条件下该反应的热化学方程式? ________________?
(3)工业上一般采用CO(g) + 2H2(g)?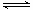 ?CH3OH(g)反应合成甲醇。
?CH3OH(g)反应合成甲醇。
下表所列数据是该反应在不同温度下的化学平衡常数的数值:
温度
| 250℃
| 300℃
| 350℃
|
K
| 2.041
| 0.270
| 0.012
|
①某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)= 0.1 mol/L,则CO的转化率为?,此时的温度?250℃(填“>”、“<”、“=”)
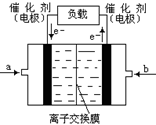
②如下图是甲醇燃料电池(电解质溶液为KOH溶液)的结示意图,则a处通入的是?
(填“甲醇”或“氧气”),b处电极上发生的电极反应是:?