微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
[? ]
A.c(H+)
B.Ka(HF)
C.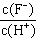
D.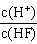
参考答案:D
本题解析:
本题难度:一般
2、选择题 水的电离平衡为H2O 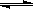 H+﹢OH-,△H>0,下列叙述不正确的是
H+﹢OH-,△H>0,下列叙述不正确的是
A.将水加热,pH减小
B.恒温下,向水中加入少量固体KOH,Kw不变
C.向水中滴入稀醋酸,c(H+)增大
D.向水中加入少量固体NaClO,平衡逆向移动
参考答案:D
本题解析:因为水溶液电离平衡反应△H>0为吸热反应,A、将水加热后电离反应吸收热量,使反应正向进行,故A正确;B、Kw只与温度有关,与溶液浓度无关,因为表示反应在恒温下进行,故B正确;C、在水溶液中滴入醋酸后醋酸发生电离反应CH3COOH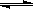 H++CH3COO-,c(H+)浓度增大,故C正确;D、 NaClO溶解放热,电离反应应正向移动,故D错误。
H++CH3COO-,c(H+)浓度增大,故C正确;D、 NaClO溶解放热,电离反应应正向移动,故D错误。
本题难度:一般
3、选择题 下列说法中正确的是( )
A.硫酸钡难溶于水,但硫酸钡属于强电解质
B.氯化钠水溶液在电流的作用下电离出Na+和Cl-
C.硫酸钠在水中的电离方程式可表示为Na2SO4===2Na++S6++4O2-
D.盐酸能导电,故盐酸属于电解质
参考答案:A
本题解析:A正确,硫酸钡虽然难溶于水,但在熔融状态下可以完全电离,属于强电解质.
B错误,电离不需要通入电流.
C错误,正确的应该为: Na2SO4===2Na++SO42-
D错误,盐酸是混合物,不属于电解质,也不属于非电解质.
本题难度:一般
4、填空题 一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示,请回答。

(1)O点为什么不导电______________________________________。
(2)a、b、c三点的pH由小到大的顺序为 ___________________ 。
(3)a、b、c三点中,醋酸的电离程度最大的一点是_____________ 。
(4)若要使c点溶液中的c(CH3COO-)增大,在如下措施中,不可行的是_________________。
A.加热 B.加水 C.加固体KOH D.加Na2CO3固体
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的是__________。
A.c(H+) B.H+个数 C.CH3COOH分子数
参考答案:(1)因为冰醋酸未电离,无自由移动的离子
(2)b<a<c
(3)c
(4)B
(5)B
本题解析:
本题难度:一般
5、简答题 浓度均为0.1摩/升的8种溶液:①HNO3②H2SO4③HCOOH④Ba(OH)2⑤NaOH⑥CH3COONa⑦KCl⑧NH4Cl,溶液pH值由小到大的顺序是(填写编号)______.
参考答案:碱有:④Ba(OH)2⑤NaOH,浓度相同时,碱性④>⑤;
水解呈碱性的有:⑥CH3COONa,但水解程度较小,则pH:④>⑤>⑥;
呈中性的有:⑦KCl;
水解呈酸性的有:⑧NH4Cl;
酸有:①HNO3②H2SO4③HCOOH,由于②为二元强酸,①为一元强酸,③为弱酸,
则PH:③>①>②,
综合以上,则pH由小到大的顺序是为:②①③⑧⑦⑥⑤④,
故答案为:②①③⑧⑦⑥⑤④.
本题解析:
本题难度:一般