| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《弱电解质电离平衡》高频试题巩固(2017年最新版)(四)
该混合溶液中离子浓度由大到小的顺序是 。 (4)丁组实验所得混合溶液中由水电离出的 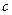 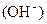 = mol·L-1。 = mol·L-1。 参考答案:(每小题3分)(1)> (2)C (3)弱 Na+>A->OH->H+ (4)10-5 本题解析:(1)若HA是弱酸,则恰好反应后是强碱弱酸溶液,呈碱性。(2)、根据电荷守恒有:c(Na+)+c(OH-)=c(H+)+c(A-) ,pH=7时,c(OH-)=c(H+),所以c(Na+)= c(A-)。 本题难度:一般 5、简答题 25℃时,几种弱酸溶液的pH如下表所示:
 (1)25℃时,Na2SO3溶液的pH______(填“>”、“<”“或“=”)7,其原因是______(用离子方程式表示). (2)图1是常温下,相同pH的CH3COOH和HCN溶液分别加水稀释时溶液的pH随溶液体积变化的曲线. ①图1中曲线______(填“Ⅰ”或“Ⅱ”)表示加水稀释HCN溶液时pH的变化. ②下列操作能使CH3COOH的电离程度与
A.加水稀释溶液? B.升高溶液温度? C.加入少量NaHSO4固体? D.加入少量CH3COONa固体 ③在图2中分别画出常温下CH3COONa溶液和NaCN溶液中由水电离出的c(OH-)与其盐浓度的变化曲线. (3)常温下,物质的量浓度相同的CH3COONa溶液和NaCN溶液中,CH3COONa溶液中各离子浓度之和______(填“>”、“<”或“=”)NaCN溶液中各离子浓度之和. (4)已知:HCN(aq) 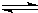 H+(aq)+CN-(aq)△H=+43.5kJ?mol-1 H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ?mol-1则NaCN在溶液中发生水解的热化学方程式: CN-(aq)+H2O(1) 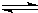 ?HCN(aq)+OH-(aq)的△H=______.该反应25℃时的平衡常数K=______. (需填具体数值,已知10-5.6=2.5×10-6) 参考答案:(1)25℃时,0.01mol/L亚硫酸的pH=2.3,则亚硫酸为弱酸,即亚硫酸钠为强碱弱酸盐,由SO32-+H2O 本题解析: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《氯及其化合.. | |