微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列分子的空间构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH2===CH2 ③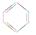 ④CH≡CH?⑤NH3 ⑥CH4
④CH≡CH?⑤NH3 ⑥CH4
A.①②③
B.①⑤⑥
C.②③④
D.③⑤⑥
参考答案:A
本题解析:①②③都是平面性结构,所以中心原子都是sp2杂化;乙炔是直线型结构,碳原子是sp杂化;氨气是三角锥形,甲烷是正四面体型结构,所以中心原子都是sp3杂化,答案选A。
本题难度:一般
2、选择题 A和M为两种元素,已知A位于短周期,且A2+与M-的电子数之差为8,则下列说法正确的( )
A.A和M的原子序数之差为6
B.A和M原子的最外层电子数之和为9
C.A和M原子的最外层电子数之差为7
D.A和M原子的电子总数之和可能为11
参考答案:A位于短周期,且A2+与M-的电子数之差为8,则A和M的原子的最外层电子数分别为2和7,且处于同一周期.
A、A和M处于同一周期,A和M的原子的最外层电子数分别为2和7,所以A和M的原子序数之差应为5.故A错误;
B、A和M处于同一周期,A和M的原子的最外层电子数分别为2和7,A和M原子的最外层电子数之和为9.故B正确;
C、A和M的原子的最外层电子数分别为2和7,A和M原子的最外层电子数之差为5,故C错误;
D、A和M可能分别为Be、F,A和M原子的电子总数之和为13;若A和M可能分别为Mg、Cl,A和M原子的电子总数之和为29.不可能为11.故D错误.
本题解析:
本题难度:简单
3、填空题 化合物A俗称石灰氮,以前是一种常用的肥料,其含氮量为35.0%,含钙量为50%。它可以用CaCO3通过下列步骤制得

请回答下列问题:
(1)写出A的化学式____________;
(2)CaC2是离子化合物,写出CaC2的电子式____________;
(3)写出B与足量的碳在高温下反应生成CaC2的化学方程式_______________________;
(4)A与水完全反应的现象是产生白色沉淀并放出气体,写出A与水完全反应的化学方程式________________________。
参考答案:(1)CaCN2
(2)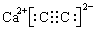
(3)CaO+3C CaC2+CO↑
CaC2+CO↑
(4)CaCN2+3H2O=CaCO3↓+2NH3↑
本题解析:
本题难度:一般
4、简答题 A、B、C、D、E原子序数依次递增的五种短周期元素,已知:
①B原子核外电子总数与最外层电子数之比为4:3
②D原子最外层电子数与次外层电子数之比为3:4
③E-,C+,A+的离子半径逐渐减小
④A单质在E单质中燃烧火焰呈苍白色
请回答下列问题:
(1)E的最高价氧化物对应水化物的化学式为:______.它的酸性比D的最高价氧化物对应水化物的酸性:______.(填“强”或“弱”)
(2)X、Y是由上述元素中任意3种组成的强电解质,且构成的原子个数比均为1:1:1.已知X溶液中水电离出来的c(H+)=10-12mol/L,则X的电子式为:______;Y的水溶液酸碱性与X相同,则其原因是(写离子方程式):______;
(3)B与C构成原子个数比为1:1的化合物与H2O反应的化学方程式为:______;
(4)A与B,A与D均可形成18个电子的分子,这两种分子在水溶液中反应生成物之一是含10电子的化合物;该反应可观察到现象是:______,原因是(用化学方程式表示)______.
参考答案:A、B、C、D、E原子序数依次递增的五种短周期元素,已知:
①B原子核外电子总数与最外层电子数之比为4:3,根据核外电子排布可知,B原子最外层电子数只能为6,则核外电子总数为8,故B为O元素;
②D原子最外层电子数与次外层电子数之比为3:4,D原子只能有3个电子层,最外层电子数为6,则D为S元素;
③结合E-、C+、A+离子的电荷可知,E处于ⅦA族,C、A处于ⅠA族,由原子序数可知,C为Na;而E-、C+、A+半径逐渐减小,故E为Cl;
④A单质在E单质中燃烧火焰呈苍白色,可推知A为H元素,
(1)E为Cl,其最高价氧化物对应水化物的化学式为:HClO4,非金属性Cl>S,故酸性HClO4>H2SO4,
故答案为:HClO4;强;
(2)X、Y是由上述元素中任意3种组成的强电解质,且构成的原子个数比均为1:1:1.已知X溶液中水电离出来的c(H+)=10-12mol/L,则X抑制水的电离,为酸或碱,则X为NaOH,其电子式为: ;Y的水溶液酸碱性与X相同,为碱性,Y为NaClO,其呈碱性原因是:ClO-+H2O?HClO+OH-,
;Y的水溶液酸碱性与X相同,为碱性,Y为NaClO,其呈碱性原因是:ClO-+H2O?HClO+OH-,
故答案为: ;ClO-+H2O?HClO+OH-;
;ClO-+H2O?HClO+OH-;
(3)O与Na构成原子个数比为1:1的化合物为Na2O2,与H2O反应生成NaOH与O2,反应化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(4)A与B、A与D均可形成18个电子的分子,分别为H2O2与H2S,H2O2具有强氧化性,与H2S反应生成S与H2O,反应方程式为:H2O2+H2S=S↓+2H2O,可以观察到:有淡黄色沉淀生成,
故答案为:有淡黄色沉淀生成;H2O2+H2S=S↓+2H2O.
本题解析:
本题难度:简单
5、选择题 实验测得BeCl2为共价化合物,两个Be-Cl键之间的夹角为180°,由此可见BeCl2属于
[ ? ]
A.由极性键构成的极性分子
B.由极性键构成的非极性分子
C.由非极性键构成的非极性分子
D.BeCl2中Be采取sp2杂化
参考答案:B
本题解析:
本题难度:简单