微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列制备金属单质的方法或原理正确的是
A.在高温条件下,用H2还原MgO制备单质Mg
B.在通电条件下,电解熔融Al2O3制备单质Al
C.在通电条件下,电解饱和食盐水制备单质Na
D.加强热,使CuO在高温条件下分解制备单质Cu
参考答案:B
本题解析:镁是活泼的金属,需要电解法冶炼,A不正确;C不正确,应该是电解熔融的氯化钠;铜的冶炼需要还原剂还原,D不正确,所以正确的答案选B。
本题难度:简单
2、判断题 为缓解能源危机,能源专家构想出了利用太阳能促使燃料循环的构想图:
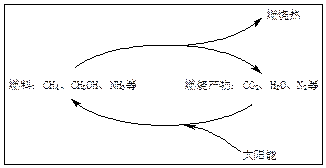
当前,科学家还未实现这一构想。但大自然已经解决了这个问题,绿色植物的光合作用就是在日光作用下,利用太阳能把CO2和H2O转变成了能源葡萄糖(可燃烧): 6CO2 + 6H2O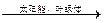 C6H12O6 + 6O2
C6H12O6 + 6O2
(1)如果上述构想成立,试写出有关反应的化学方程式。
(2)在此构想的物质循环中,太阳能最终转化为___________能。
(3)实现上述构想的关键问题是什么?
参考答案:(1)CO2 + 2 H2O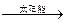 CH4 + 2O2;2CO2 + 2H2O
CH4 + 2O2;2CO2 + 2H2O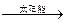 2CH3OH + 3O2; 2N2 + 6H2O
2CH3OH + 3O2; 2N2 + 6H2O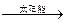 4NH3 + 3O2。(2)热 (3)问题的关键是是如何使燃烧产物吸收太阳能,故需要研制新型高效吸收太阳能的材料(如人工叶绿素)。
4NH3 + 3O2。(2)热 (3)问题的关键是是如何使燃烧产物吸收太阳能,故需要研制新型高效吸收太阳能的材料(如人工叶绿素)。
本题解析:能源问题是化学与社会中的重要一项。太阳能是一种巨大、无污染、最经济的能源。可以说地球上的能源归根到底主要是来自于太阳。光合作用是地球上利用光能将无机物转变成有机物的作用。从上面箭头所示的循环过程中,太阳能最终变成热能。目前开发利用太阳能的关键是解决光能的吸收问题,故“人工叶绿素”就成为当前能源科学家研究开发的热点。由题给化学方程式可知,该反应为葡萄糖燃烧反应的逆向过程,按照这一思路,可实现如下变化:
2 CO2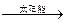 2 CO + O2;2 H2O
2 CO + O2;2 H2O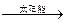 2 H2 + O2……
2 H2 + O2……
本题难度:简单
3、选择题 “纳米材料”是指开发研究出的颗粒直径从几纳米至几十纳米的材料.若将“纳米材料”分散到液体分散剂中,所得混合物一定具有的性质是(?)
A.该分散系属于悬浊液
B.能全部透过半透膜
C.一束光线通过该分散系时,有丁达尔现象
D.通过直流电,会发生电泳
参考答案:C
本题解析:略
本题难度:简单
4、填空题 (1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”(侯氏制碱法)两种工艺。
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式:_________________________________________________;
②写出“联合制碱法”有关反应的化学方程式_________________?_;?。
③CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?________________________________________;
(2)钢铁工业对促进经济和社会发展起了重要作用。
①炼钢时,加入硅、锰和铝的目的是_______________________________。
②不锈钢含有的Cr元素是在炼钢过程的氧吹__?__(填“前”或“后”)加入。
③炼铁和炼钢生产中,尾气均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作_________。
参考答案:(1)①2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O?(2分)
2NH3↑+CaCl2+2H2O?(2分)
②NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl?(2分)
2NaHCO3 Na2CO3+CO2↑+H2O?(2分)
Na2CO3+CO2↑+H2O?(2分)
(或写总反应方程式:2NaCl+2NH3+CO2+H2O=Na2CO3+2NH4Cl)
③“氨碱法”CO2来源于石灰石煅烧,“联合制碱法”CO2来源于合成氨工业的废气;(2分)
(2)①脱氧和调整钢的成分?(2分)
②后 (1分)
③CO (2分)?燃料(或还原剂)?(2分)
本题解析:(1)?①氨碱法中为回收氨而使石灰乳与副产物氯化铵反应,从而产生大量CaCl2废渣。2NH4Cl + Ca(OH)2=CaCl2+2H2O+2NH3↑;②联合制碱法的主要化学反应为:
NaCl(饱和)+CO2+NH3+H2O=NaHCO3↓+NH4Cl? 2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
③氨碱法的CO2来源于石灰石的煅烧,“联合制碱法”的CO2来源于合成氨工业的废气;
(2)①炼钢时,加入硅、锰和铝主要是可以脱氧和调整钢的成分;②?因为Cr易被氧化,为防止Cr被氧化,不锈钢含有的Cr元素是在炼钢过程的氧吹后,若氧吹前加入Cr会形成炉渣被除去;③炼铁和炼钢生产中,CO是主要的还原剂,故尾气均含有的主要污染物是CO,一氧化碳会引起中毒,故需对其进行处理。
本题难度:一般
5、填空题 过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
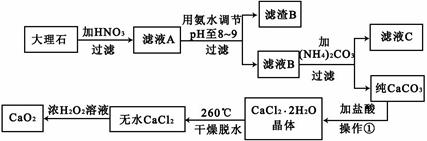
请回答下列问题:
(1)用氨水调节pH至8——9的目的是?。
(2)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+?(填“是”或“否”)沉淀完全。(已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9)
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH4+) ?c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式:?,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9——11,才出现大量沉淀。用化学方程式和简要的文字解释需用氢氧化钠调节pH至9——11的原因?。
参考答案:(1)除去Fe3+?; (2)是?;(3)<;
(4)CaCl2+H2O2 CaO2+2HCl(或CaCl2+H2O2+2NaOH = CaO2↓+2NaCl+2H2O);?加入NaOH溶液使上述平衡向正反应方向,有利于CaO2沉淀的生成。
CaO2+2HCl(或CaCl2+H2O2+2NaOH = CaO2↓+2NaCl+2H2O);?加入NaOH溶液使上述平衡向正反应方向,有利于CaO2沉淀的生成。
本题解析:根据图示信息,可得出:滤液A的成分有硝酸钙和硝酸铁以及剩余的硝酸,当pH至8-9范围段内时,三价铁可易形成沉淀,所以滤渣B是氢氧化铁,滤液B是硝酸钙,和碳酸铵之间可以发生复分解反应生成碳酸钙和硝酸铵,过滤,沉淀碳酸钙用盐酸溶解然后蒸发结晶可以得到氯化钙晶体,再失水成为无水氯化钙,双氧水可以和氯化钙反应生成过氧化钙和盐酸.
(1)用氨水调节pH至8-9,三价铁可易形成沉淀,从而分离出硝酸钙溶液,故答案为:除去Fe3+;
(2)若测得滤液C中c(CO32-)=10-3 mol/L,Ksp(CaCO3)=4.96×10-9;Ksp=Ca2++CO32-=10-3 mol/L×c(Ca2+)=4.96×10-9 ,c(Ca2+)=4.96×10-6 mol/L,已知c(Ca2+)≤10-5mol/L可视为沉淀完全,所以此时钙离子沉淀完全;故答案为:是;
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,铵根离子水解,则酸化后溶液中c(NH4+)<c(NO3-);故答案为:<;
(4)双氧水可以和氯化钙反应生成过氧化钙和盐酸,即CaCl2+H2O2=CaO2↓+2HCl,加入NaOH溶液使上述平衡向正反应方向,有利于CaO2沉淀的生成;
本题难度:困难