微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质的转化或分离错误的是(?)
A.煤干馏可转化为焦炉气、煤焦油、焦炭等
B.原油分馏可分离出汽油、煤油、柴油等
C.从海水中得到的无水MgCl2可用电解的方法获得镁
D.从碘水中得到碘,可用酒精萃取
2、实验题 无水氯化亚铁用于制造铁系催化剂、印染的媒染剂和染料还原剂,还可用于冶金、医药、照相等行业。一实验小组模仿工业方法制取氯化亚铁,设计装置如下
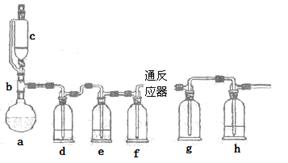
通过查阅相关资料可知:
①在持续高温500℃时,铁与纯净、干燥Cl2反应可生成FeCl2,在温度较低时可生成FeCl3;
②FeCl3熔沸点低,易升华。
根据以上信息回答相关的问题
(1)abc仪器组合成制取氯气的装置,反应无需加热,请写出a容器内所发生的化学反应方程式?。
(2)d、e盛装的药品分别是?和?,f、g的作用是?。
(3)反应器为硬质玻璃管,纯净铁粉与氯气在500℃左右反应。
①化学反应方程式为?
②实验操作顺序是:组装仪器、?、装入药品、?、?、停止加热、关闭c的活塞。
(4)实验小组记录的实验现象如下:
?
| 观察到的部分现象
|
第一次实验
| 反应器中有白雾、红色固体、g瓶有白雾和黄绿色气体
|
第二次实验
| 反应器中有绿色晶体,g瓶有红棕色的烟和黄绿色气体
|
第三次实验
| 反应器中有绿色晶体,g瓶有黄绿色气体
|
?
①第一次实验,发现e瓶没有盛装任何药品,所以得到红色固体,其原因是?。
②第二次实验,g瓶有红棕色的烟,其原因是?。
(5)第三次实验得到的固体,最可能含有微量杂质是?,如果需要配制约2~3mol/L的染料还原剂溶液,则无需除去,理由是?。
3、实验题 某化学实验小组为验证常见还原剂SO2、I-、Fe2+的还原性强弱的顺序为:
SO2>I->Fe2+,用下图所示装置进行实验(加热和夹持装置已略,气密性已检验)。
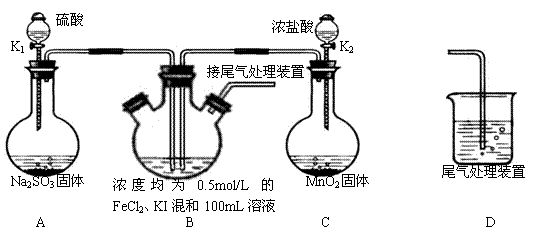
(1)上述实验需要加热的装置是
(2)D中,烧杯盛放的是
(3)实验开始时,关闭K1,打开K2,通入少量氯气,写出B中发生反应的离子方程式 ________________
①为验证I-的还原性比Fe2+强,取(3)后B中的少量溶液于试管中,应再往试管中滴入 ________ 溶液,现象是
②在(3)后,为了比较SO2和I-的还原性强弱,接下来的操作是
A.关闭K2开K1
B.关闭K1打开K2
C.同时打开K1和K2
(4)若打开K2,通入Cl2恰好将Fe2+、I-全部氧化后,再打开K1通入SO2,当Fe3+全部转化为Fe2+时,此时通入的SO2的体积(标准状况下)为 ?________?
4、填空题 (12分)某同学用10mol? L-1 的浓盐酸配制250mL 1mol? L-1 的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸____________mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有________________、___________。
(3)实验室中所用少量氯气用下列方法制取:4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O。
Cl2↑+MnCl2+2H2O。
试回答下列问题:
该反应中_____________是氧化剂,氧化产物是_______________。
若产生标准状况下的Cl2 2.24L,则被氧化的HCl__________mol。
5、填空题 (14分)某学生实验小组拟用孔雀石(主要成分是Cu(OH)2·CuC03,其杂质主要为FeC03等)制胆矾,实验设计流程如下:

回答下列问题:
(1)步骤(a)中,实验研磨孔雀石的仪器名称?;用硫酸浸取的化学方程式:?
(2)步骤(b)中,pH控制在3.O~3.5,其目的是?;加过氧化氢发生反应的离子方程式为?。
(3)怎样判断蒸发浓缩已完成:?。
(4)将制得的样品用热重仪进行热重分析,热重仪原理及热重记录如下表:
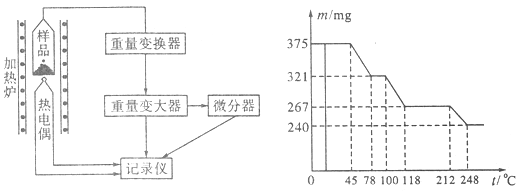
写出212~248℃温度范围内发生反应的化学方程式?。
(5) FeC03为白色沉淀,此沉淀的Ksp(FeC03)=2×10-11,将FeCl2的稀溶液与Na2CO3溶液等体积混合,若FeCl2的浓度为2×lO一5mol·L-1.则生成沉淀所需Na2CO3溶液的最小浓度为?mol·L-1。