微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (20分)工业上常利用含硫废水生产Na2S2O3?5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。
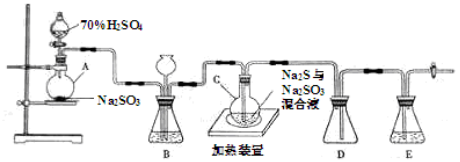
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)?(I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)?(II)
S(s)+Na2SO3(aq) Na2S2O3(aq)?(III)
Na2S2O3(aq)?(III)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若?,则整个装置气密性良好。装置D的作用是?
??。装置E中为?溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为?。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择?。
a.蒸馏水? b.饱和Na2SO3溶液
c.饱和NaHSO3溶液? d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是?。已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是?。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器含有?。
a.烧杯? b.蒸发皿? c.试管? d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3?5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:
?。
已知Na2S2O3?5H2O遇酸易分解:S2O32?+2H+=S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
2、填空题
①将浓氨水逐滴滴入装有生石灰的烧瓶中,可以制取氨气。
②取1mL 20%蔗糖溶液,加入适量稀硫酸,水浴加热约5min后,再加入少量新制的Cu(OH)2,加热,可检验蔗糖是否发生水解。
③配制一定物质的量浓度的NaCl溶液时,定容后摇匀,发现液面又低于刻度线,此时无须再加入蒸馏水。
④用小刀切取少量金属钠做实验,切剩的钠要立即放入原试剂瓶。
⑤在含I—的溶液中加入适量稀硫酸与H2O2(3%),再用酒精萃取,可以提取单质碘。
3、实验题 某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
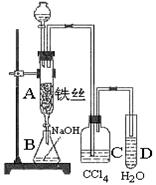
(1)写出A中反应的化学方程式:?
(2)A中的现象是?。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是?,写出有关的化学方程式 ?。
(4)C中盛放CCl4的作用是?。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入?,现象是??
4、填空题 (15分)
阅读分析材料,据此完成下列要求。
工业纯碱中常含有少量的NaCl和NaOH。某校课外活动小组的同学为测定纯碱样品中
Na2CO3的质量分数,选择下列适当装置进行连接,并对设计方案不断完善,成功完成了
测定实验。
?
⑴活动小组的五位同学对实验装置的设计进行了讨论发言,内容如下:
甲:将装置A和E连接即可。因为Na2CO3与稀硫酸反应生成的CO2被E中的碱石灰吸收,分别测量反应前和反应后E的总质量,就可求出Na2CO3的质量分数。
乙:还应在A和E之间连接装置?(填序号),其目的是?。
丙:应该用B装置取代A装置。从B装置的导管口处缓慢鼓入空气,其目的是?。
丁:若直接向B装置中鼓入空气会导致实验测定结果?(填“偏高”、“偏低”或
“无影响”),因此,应将鼓入的空气先通过装置?(填序号)。
戊:E装置后还应连接装置F,其作用是?。
⑵学生课外活动小组测定的数据如下,计算该工业纯碱中Na2CO3的质量分数为?。
工业纯碱样品质量
| 反应前E的总质量
| 反应后E的总质量
|
6.4g
| 51.9g
| 54.1g
|
⑶简述实验室测定上述样品中Na2CO3的质量分数的另一种方法(含实验仪器、实验步骤、实验现象)??。
5、实验题 Fe、Cu都是人类最早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题
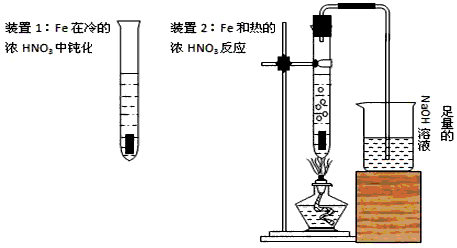
(1)甲同学为验证Fe在冷的浓HNO3中发生钝化但能和热的浓HNO3反应,设计了如图所示的实验,请你指出其中的两处错误:①_______________②_______________纠正上述错误后,如将装置2中的铁片改成一段一端为螺旋状的铁丝,呈螺旋状的一端深入硝酸中,另一端伸出橡皮塞外,这种改进的优点是___________________________
(2)乙同学将甲同学的Fe和浓HNO3反应后的溶液冷却,再将溶液倒入烧杯中并加入一块Cu片,发现Cu片逐渐溶解。
① 乙同学依据反应中某一现象得出了甲同学试验后HNO3过量的正确结论,他依据的反应现象是______________________________
② 乙同学认为铜片溶解可能还有另一化学反应存在的原因,该反应的离子方程式是_______________
(3)请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象_______________________
(4)丙同学取0.05molCu与足量浓HNO3反应,采用了正确的试验方法,但收集产生的气体不足0.1mol,最有可能的原因是_______________(用化学方程式表示)