微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是? ( )
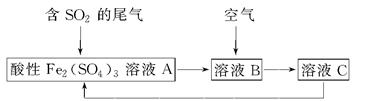
A.溶液B中发生的反应为2SO2+O2=2SO3
B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+
C.由以上流程可推知氧化性:Fe3+>O2>SO42—
D.此工艺的优点之一是物质能循环利用
参考答案:D
本题解析:本题以综合处理SO2废气的工艺流程为载体,考查氧化还原反应的相关知识。结合题中流程可以分析得出其中涉及2个反应,依次为2Fe3++SO2+2H2O=2Fe2++SO42—+4H+、4Fe2++O2+4H+=4Fe3++2H2O,故A错,同时由以上两个氧化还原反应方程式可知C错;用酸性高锰酸钾溶液只能检验溶液C中是否含有Fe2+,而不能检验Fe3+,B错。
本题难度:简单
2、选择题 危险化学品的包装标签上要印有警示性标志。下列物质选用“腐蚀品”标志的是(?)
A.汽油
B.食盐
C.浓硫酸
D.炸药
参考答案:C
本题解析:略
本题难度:简单
3、选择题 下列说法一定正确的是(?)
A.氯碱工业中若阳极产生0.1mol氯气则通过溶液的电子的物质的量为0.2mol
B.1L 1mol/LNa2CO3溶液中阴离子和阳离子的总数为3×6.02×1023
C.当碳酸溶液的PH增大1时,溶液中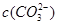 可能增大也可能减小
可能增大也可能减小
D.乙烯和苯分子中都存在碳碳双键,都能发生加成反应
参考答案:C
本题解析:电化学中电子只能在导线中传递,而不能在溶液中,A不正确。碳酸钠水解显碱性,应用消耗1mol碳酸钠产生1mol碳酸氢钠和1mol氢氧化钠,所以溶液中阴离子和阳离子的总数大于3×6.02×1023,B不正确。碳酸的酸性增强,其电离平衡可能被抑制,也可能被促进,C增强。苯分子中不存在碳碳双键,D不正确,答案选C。
本题难度:简单
4、实验题 (16分)氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:
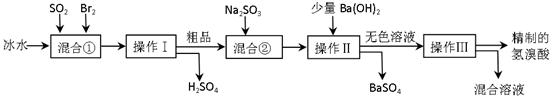
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为?。
(2)混合①中使用冰水的目的是?。
(3)操作Ⅱ和操作Ⅲ的名称分别是?、?。
操作Ⅲ一般适用于分离____________混合物。(选填编号)
a.固体和液体? b.固体和固体? c.互不相溶的液体? d.互溶的液体
(4)混合②中加入Na2SO3的目的是?。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为?,若假设成立可观察到的现象为?。
乙同学假设工业氢溴酸呈淡黄色是因为_______,其用于证明该假设所用的试剂为?。
参考答案:
(1)SO2+Br2+2H2O → 2HBr+H2SO4。(3分)(2)降低体系温度,防止溴蒸发,使反应完全。(2分)
(3)过滤、蒸馏。d。(3分)
(4)除去粗品中未反应完的溴。(3分)
(5)KSCN溶液,溶液变成血红色。(3分)含有Br2,CCl4。(3分)
本题解析:略
本题难度:简单
5、实验题 【化学——化学与技术】
1942年我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NaHCO3↓+NH4Cl
2NaHCO3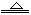 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,已知合成氨为放热反应,若从勒夏特列原理来分析,合成氨应选择的温度和压强是?(选填字母)。
a.高温? b.低温? c.常温? d.高压? e.低压? f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是?(选填字母)
a.碳酸氢钠难溶于水?
b.碳酸氢钠受热易分解?
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通人含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中央持、固定用的仪器未画出)。
实验结束后,分离出NaHCO3晶体的操作是?(填分离操作的名称)。
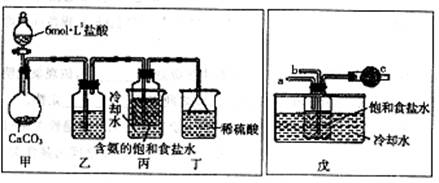
第二位同学:用图中戊装置进行实验(其它装置未画出)。
为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入?气体,再从b管中通入?气体。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用相关的化学反应方程式来描述):?。
参考答案:
(1)bd(2)c(3)过滤,氨气,CO2

本题解析:
(1)合成氨为气体物质的量减少的放热反应,高压、低温有利于提高氨的平衡浓度,从勒沙特列原理可以选择bd。
(2)根据复分解反应完成的条件可知,NaHCO3的溶解度较小,是析出碳酸氢钠晶体的主要原因,选c。
(3)固液分离操作用过滤操作。由于CO2的溶解度较小,因此通入CO2前,应先从a管通入氨气(防止NH3倒吸),因为氨气、H2O、CO2反应生成NH4HCO3,可以大大提高CO2的吸收,b管通入CO2有利于CO2的充分吸收。
(4)可以将过量的CO2通入NaOH溶液或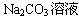 中。
中。
本题难度:简单