微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 准确称取6 g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100 mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示:
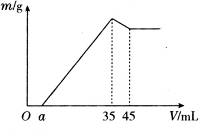
请填空回答:(1)H2SO4溶液的物质的量浓度为_________________。
(2)若a=2.3,用于沉淀Fe3+消耗NaOH的体积是____________mL,铝土矿中各组成分的质量分数:Al2O3为______________,Fe2O3为______________,SiO2为______________。
(3)a值的范围应是______________,在这个范围内,a值越大______________的质量分数越小。
参考答案:(1)1.75 mol·L-1
(2)2.7? 85%? 12%? 3%
(3)1.625<a<5? Fe2O3
本题解析:(1)从图中可知,当加入35 mL NaOH溶液时沉淀质量达到最大值,此过程可表示为:
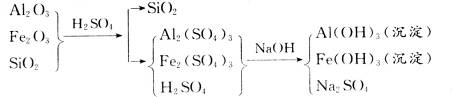
由图示关系知,当最后溶液中溶质中有Na2SO4时,沉淀的质量最大,此时n(NaOH)="10" mol·L-1×0.035 L="0.35" mol,由此建立加入H2SO4和NaOH的物质的量的关系:
H2SO4—Na2SO4—2NaOH
1? 2
0.175 mol0.35 mol
故c(H2SO4)="0.175" mol/0.1 L="1.75" mol·L-1。
(2)为了方便解答问题(3),在计算有关成分的质量分数时,保留a至最后。由图可知,溶解Al(OH)3消耗NaOH为10 mol·L-1×(45-35)×10-3 L="0.1" mol。
 Al2O3—? Al3+—? Al(OH)3—? OH-
Al2O3—? Al3+—? Al(OH)3—? OH-
0.05 mol? 0.1 mol? 0.1 mol? 0.1 mol
Al2O3的质量分数为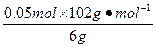 ×100%=85%
×100%=85%
沉淀Al3+耗NaOH 0.3 mol,沉淀Al3+和Fe3+共耗NaOH 10 mol·L-1×(35-a)×10-3 L,故沉淀Fe3+耗NaOH:10 mol·L-1×(35-a)×10-3 L-0.3 mol=(0.05-0.01a)mol
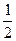 Fe2O3?—? Fe3+?—? 3OH-
Fe2O3?—? Fe3+?—? 3OH-
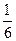 (0.05-0.01a)mol?(0.05-0.01a)mol
(0.05-0.01a)mol?(0.05-0.01a)mol
Fe2O3的质量分数为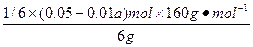 ×100%=
×100%=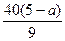 %
%
SiO2的质量分数为1-85%-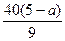 %=
%=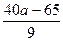 %
%
最后把a=2.3代入上述有关代数式,得沉淀Fe3+消耗NaOH的体积:
V(NaOH)=(0.05-0.01a)mol/10 mol·L-1=(0.05-0.01×2.3)mol/10 mol·L-1=2.7×10-3L="2.7" mL。故Fe2O3的质量分数为12%;SiO2的质量分数为3%。
(3)因为Al2O3的质量分数与a值无关,即为85%,则Fe2O3质量分数必然满足下列不等式:0<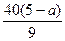 %<15%,解此不等式得:1.625<a<5,结合w(Fe2O3)和w(SiO2)知,a值越大,w(Fe2O3)越小,w(SiO2)越大。
%<15%,解此不等式得:1.625<a<5,结合w(Fe2O3)和w(SiO2)知,a值越大,w(Fe2O3)越小,w(SiO2)越大。
本题难度:简单
2、选择题 下列各组物质,若不用其他试剂,则无法鉴别的是(?)
A.MgCl2、Na2CO3
B.AlCl3、NaOH
C.NaAlO2、HCl
D.稀H2SO4、Na2CO3
参考答案:A
本题解析:通过反滴实验可鉴别:
B向AlCl3中滴入NaOH:先产生白色沉淀,后沉淀溶解。
离子方程式:Al3++3OH-====Al(OH)3↓,Al(OH)3+OH-====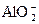 +2H2O
+2H2O
向NaOH中滴入AlCl3:开始振荡后无现象,出现白色沉淀后不再溶解。
离子方程式:Al3++4OH-====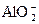 +2H2O
+2H2O
3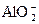 +Al3++6H2O====4Al(OH)3↓
+Al3++6H2O====4Al(OH)3↓
C.向NaAlO2中滴入盐酸:先产生白色沉淀,后沉淀逐渐溶解。
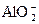 +H2O+H+====Al(OH)3↓,Al(OH)3+3H+====3H2O
+H2O+H+====Al(OH)3↓,Al(OH)3+3H+====3H2O
向盐酸中滴入NaAlO2:先无明显现象,后出现白色沉淀且不溶解。
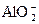 +4H+====Al3++2H2O,3
+4H+====Al3++2H2O,3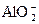 +Al3++6H2O====4Al(OH)3↓
+Al3++6H2O====4Al(OH)3↓
D.向稀H2SO4中滴入Na2CO3,开始就有气体。
H++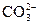 ====
==== ,
, +H+====H2CO3,H2CO3====H2O+CO2↑
+H+====H2CO3,H2CO3====H2O+CO2↑
向Na2CO3中滴入少量稀H2SO4:无气体,H++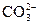 ====
====
本题难度:简单
3、选择题 硫酸镁和硫酸铝的混合溶液中,Al3+的浓度为0.2 mol·L-1,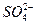 的浓度为0.4 mol·L-1,则混合溶液中Mg2+物质的量浓度为(?)
的浓度为0.4 mol·L-1,则混合溶液中Mg2+物质的量浓度为(?)
A.0.4 mol·L-1
B.0.3 mol·L-1
C.0.2 mol·L-1
D.0.1 mol·L-1
参考答案:D
本题解析:根据电荷守恒规律:3c(Al3+)+c(Na+)=2c(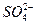 ),将已知条件代入后即得解。
),将已知条件代入后即得解。
本题难度:一般
4、选择题 某氧化物不溶于水,溶于NaOH溶液中,生成易溶于水的化合物,向稀盐酸中滴入该溶液,有白色沉淀生成,则原氧化物是(?)
A.Al(OH)3
B.MgO
C.Fe2O3
D.Al2O3
参考答案:D
本题解析:略
本题难度:简单
5、选择题 11.9gMg、Al、Fe组成的合金溶解于足量的NaOH溶液,合金质量减少2.7g,另取等质量的合金溶解于足量的硝酸中,反应后产生标准状况下的6.72LNO,向所得溶液中加入适量的NaOH溶液恰好使金属离子转化为沉淀,则沉淀为(?)g
A.22.1
B.27.2
C.30
D.14.6
参考答案:B
本题解析:将合金溶于过量稀硝酸中,分别生成Al3+、Fe3+、Mg2+离子,根据电子守恒,金属共失去电子的物质的量为6.72L/(22.4L/mol)×3=0.9mol,反应中金属失去电子的物质的量等于生成碱的氢氧根离子的物质的量,即n(OH-)=0.9mol,所以反应后沉淀的质量等于11.9g+0.9mol×17g/mol=27.2g,故选B。
点评:本题如果利用化学方程式一步一步计算得话,将会有很大的计算量,所以可以利用最后的电荷守恒来计算,这是解题技巧之一。
本题难度:简单